Глава 2 Современные представления о причинах заболевания
Два основных механизма в развитии болезни – инсулинорезистентность и относительный дефицит инсулина
Сахарный диабет 2-го типа является гетерогенным (связанным с разными причинами) заболеванием, развивающимся в результате взаимодействия наследственной предрасположенности и негативного влияния факторов внешней среды. Генетическая предрасположенность к сахарному диабету 2-го типа является практически 100 %-ной. Но, в настоящее время первичный генетический дефект, ответственный за развитие заболевания, до конца не установлен. Важную роль играет ожирение, старение и внутриутробные факторы, способствующие развитию инсулинорезистентности.

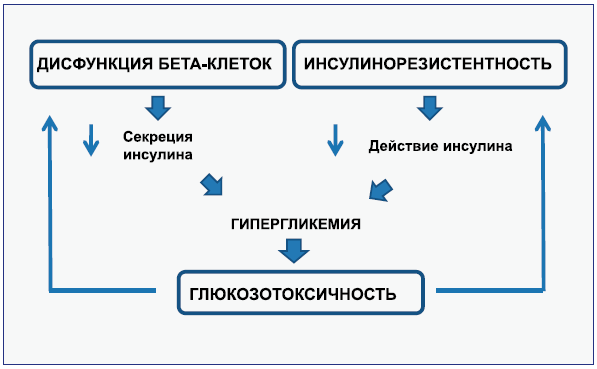
Почему происходит повышение в крови концентрации глюкозы? Ответственны за это дефектные β-клетки поджелудочной железы или ткани организма теряют чувствительность к инсулину (инсулинорезистентность)? В подавляющем большинстве случаев заболевание развивается при сочетании этих основных механизмов, каждый из которых играет важную роль. Согласно мнению профессор Ральфа Де Фронзо, патофизиология сахарного диабета 2-го типа представляет собой кульминацию двух одновременно протекающих процессов: с одной стороны – инсулинорезистентность, с другой – недостаточность функции островковых клеток поджелудочной железы для того, чтобы преодолеть слабую чувствительность тканей путем повышения уровня инсулина. В последнее время активно обсуждается вопрос о роли инкретиновой системы в патогенезе сахарного диабета 2-го типа, но об этом – позже.
Хорошо известно, что β-клетки поджелудочной железы играют основную роль в поддержании уровня глюкозы в крови (гликемии) в достаточно узком диапазоне. По мнению Р. D. Ноте (2000), уровень глюкозы в норме у лиц молодого и среднего возраста абсолютно стабилен в течение ночи и составляет непосредственно перед завтраком 4,3 ммоль/л (77 мг%). После завтрака концентрация глюкозы повышается, достигая 7,0 ммоль/л (126 мг%) в течение 30 минут, затем снижается, достигая показателя 5,5 ммоль/л (100 мг%) в течение почти такого же времени. Базальная (постоянно действующая) секреция инсулина осуществляется непрерывно и обеспечивает превращение свободно циркулирующей в крови глюкозы в гликоген (физиологический запас углеводов). Все эти биохимические процессы проходят в печени и в периферических тканях (мышцы, жировая ткань).
Необходимо отметить, что в норме β-клетки быстро адаптируются к снижению чувствительности к инсулину на уровне печени или периферических тканей, повышая секрецию инсулина в нужное время и предотвращая резкое повышение концентрации глюкозы в крови (гипергликемии) натощак. При сахарном диабете 2-го типа гипергликемия натощак развивается в случаях недостаточной функции β-клеток в плане производства и секреции инсулина, необходимого для преодоления инсулинорезистентности. Следует отметить, что гипергликемия при сахарном диабете 2-го типа после 12–14 часового голодания (натощак), в основном, зависит от значительного увеличения (40-140 %) скорости продукции глюкозы печенью (Gerich J. E., 1991, De Fronzo R. A., 1992). Известно, что после еды (постпрандиальный период) глюкоза попадает в кровь непосредственно из усвоенных с пищей углеводов, а затем распределяется, в основном в скелетные мышцы. Процесс распределения и усвоения глюкозы тканями и обеспечивается инсулином. Но для этого специализированные клетки поджелудочной железы должны иметь способность к быстрому увеличению продукции инсулина, чего и не хватает больным, страдающим сахарным диабетом 2-го типа. Это обстоятельство приводит к резкому повышению концентрации глюкозы в крови после еды (постпрандиальная гипергликемия).
Важно, что постпрандиальная гипергликемия может развиваться и существовать в течение нескольких лет до развития и появления гипергликемии натощак и до появления первых клинических признаков сахарного диабета, поэтому так важно измерять сахар крови не только натощак, но и через 2 часа после еды.
Очевидно, что у больных сахарным диабетом 2-го типа повышение секреции инсулина в ответ на прием пищи замедлено и ослаблено. А у некоторых пациентов инсулиновый ответ на прием пищи вообще отсутствует – очевидная слабость эндокринных клеток поджелудочной железы.
Известно, что существуют и неглюкозные стимулы секреции инсулина, такие как аминокислоты, свободные жирные кислоты и гормоны, механизмы нервной регуляции. Но главным стимулом для выработки инсулина, остаётся глюкоза, попадающая в кровь в результате переработки пищи.
Инсулинорезистентность периферических тканей имеет важное значение в развитии сахарного диабета 2-го типа. Инсулинорезистентность – это нарушение биологического ответа чувствительных клеток тканей на воздействие инсулина при достаточной его концентрации в крови. Клинически наиболее важна потеря чувствительности к инсулину на уровне мышечной, жировой и печеночной тканей.
Известно, что инсулинорезистентность играет значительную роль не только в развитии диабета, но и в комплексе нарушений всех видов обмена веществ, который называют метаболическим синдромом. Часто инсулинорезистентность обнаруживается в связи с артериальной гипертензией, ожирением, повышением уровня холестерина в крови и ранним атеросклерозом.
Итак, инсулинорезистентность – это невосприимчивость тканей к действию инсулина.
Вполне понятно, что в этом случае в крови повышается уровень инсулина, а часто и глюкозы. Инсулинорезистентность рассматривается в настоящее время как ведущее патофизиологическое нарушение в развитии сахарного диабета 2-го типа, предшествующее декомпенсации функции 6-клеток поджелудочной железы, которая обусловлена длительным напряжением их функции. Гипергликемия замыкает «порочный круг», вызывая снижение чувствительности 6-клеток к действию глюкозы и инсулина, что усиливает выраженность секреторного дефекта 6-клеток (феномен «глюкозотоксичности»).
Важно отметить, что биологические эффекты инсулина заключаются в регуляции разных метаболических процессов (обмен углеводов, жиров и белков). Инсулин оказывает влияние на состояние и деление клеток (рост и дифференцировка тканей, синтез ДНК). Следовательно, проблема инсулинорезистентности касается не только глюкозы, а включает в себя и нарушение обмена белков, жиров, функции эндотелия сосудов и даже процессы, связанные с генетической информацией.
Механизмы, лежащие в основе инсулинорезистентности, окончательно не установлены. Хорошо известно, что свое биологическое действие на уровне клетки инсулин осуществляет посредством связи со специфическим инсулиновым рецептором – чувствительной к инсулину частью оболочки клетки. На рецепторном уровне инсулинорезистентность является следствием уменьшения числа рецепторов на поверхности клетки, либо снижением их сродства к инсулину. Данные изменения могут быть генетически обусловлены или развиваться под влиянием внешних факторов. Однако молекулярные механизмы, определяющие развитие устойчивости к инсулину до сих пор окончательно не изучены. Предполагают, что феномен инсулинорезистентности имеет прочную генетическую основу, закрепленную в ходе эволюции. Согласно гипотезе об «экономном генотипе», выдвинутой V. Neel еще в 1962 году, инсулинорезистентность – это эволюционно закрепленный механизм выживания в неблагоприятных условиях, когда периоды изобилия чередовались с периодами голода. Наличие инсулинорезистентности обеспечивало накопление энергии в виде отложений жира, запасов которого хватало на то, чтобы пережить голод. В ходе естественного отбора как наиболее целесообразные закреплялись те гены, которые обеспечивали инсулинорезистентность и накопление энергии. В настоящее время в странах с высоким уровнем жизни, сохранившиеся в генетической памяти механизмы инсулинорезистентности, продолжают «работать» на накопление энергии, что приводит к абдоминальному ожирению, дислипидемии, гипертонии и сахарному диабету 2-го типа.
Важно отметить, что инсулинорезистентность тканей не всегда сопровождается развитием сахарного диабета 2-го типа, но является тем провоцирующим фактором, который «проверяет на прочность» функциональную способность β-клеток поджелудочной железы.
Связь диабета с нарушениями жирового обмена
Установлено, что инсулинорезистентность определяется тканями-мишенями, к которым относятся мышечная, жировая и печеночная ткани. Поскольку 75 % глюкозы утилизируется скелетной мускулатурой, то, естественно, наиболее частой причиной резистентности к инсулину может быть нарушение захвата глюкозы скелетными мышцами. Инсулинорезистентность мышечной ткани является наиболее ранним, возможно, генетически определяемым дефектом, который намного опережает клиническую манифестацию сахарного диабета 2-го типа.
Снижение концентрации инсулина в печени характеризуется уменьшением синтеза гликогена, активацией процессов его распада, что, в конечном счете, приводит к повышению продукции глюкозы печенью.
Другим звеном, играющим значительную роль в развитии гипергликемии, является устойчивость жировой ткани к действию инсулина. В результате окисления жиров, в обилии поступающих с пищей, освобождается большое количество свободных жирных кислот. Повышение уровня жирных кислот ведет к подавлению процессов транспорта и усвоения глюкозы и, как следствие, к снижению синтеза гликогена в мышцах.
Не вызывает сомнений тот факт, что длительное повышение уровня свободных жирных кислот оказывает прямое повреждающее действие на β-клетки поджелудочной железы, снижая их секреторную способность (эффект «липотоксичности»). Дислипидемия – нарушения жирового обмена, проявляющаяся в изменении соотношения липидов низкой и высокой плотности – может стать одним из проявлений инсулинорезистентности.
Но существует и обратная связь: нарушения липидного обмена в свою очередь влияют на выраженность инсулинорезистентности. При ожирении и дислипидемии снижается количество транспортеров глюкозы в жировой и мышечной ткани. Нарушается утилизация глюкозы на периферии, в первую очередь за счет уменьшения активности фермента – гликогенсинтетазы.
Таким образом, можно говорить о взаимном отягощении нарушений жирового, углеводного обменов и феномена инсулинорезистентности. Состояние инсулинорезистентности и высокий риск развития сосудистых осложнений характерны для лиц с ожирением. Известно, что более чем у 90 % больных, страдающих сахарным диабетом 2-го типа, отмечается избыточная масса тела. При этом, обнаруживается прямая связь между ожирением и инсулинорезистентностью. Доказано, что ведущим механизмом в развитии резистентности к инсулину является избыточное накопление жировой ткани, особенно в области живота – абдоминальное ожирение. Абдоминальное ожирение характеризуется увеличением окружности талии более 80 см у женщин и более 94 см у мужчин.
Впервые Vague J. еще в 1947 году высказал предположение о связи распределения жировой ткани с риском развития сопутствующих заболеваний. Он описал два типа ожирения: андроидный (мужской), который характеризуется неравномерным распределением жира с его избыточным отложением в верхней половине туловища и живота, и гипоидный (женский), для которого характерно равномерное распределение жира с преобладанием в области ягодиц и бедер. Было показано, что именно андроидное ожирение чаще сочетается с сахарным диабетом, артериальной гипертонией и другими сердечно-сосудистыми заболеваниями. Позднее это предположение было подтверждено многочисленными исследованиями.
Данные Гетебургского исследования подтвердили, что один из маркеров висцерального ожирения (внутренних органов), отношение объема талии к объему бедер (ОТ /ОБ), является независимым фактором риска инфаркта миокарда, инсульта и повышает риск смертности от них.
Необходимо отметить, что если ранее жировая ткань рассматривалась как статическое энергетическое депо, в последние же годы она оценивается как самостоятельный эндокринный орган, обладающий эндо- и паракринной функцией. Недавние исследования по изучению физиологии жировой ткани показали, что она является своеобразным секреторным органом, производящим более 90 биологически активных веществ (адипокинов). Оказалось, что адипокины (среди них лептин, фактор некроза опухоли-01 (ФНО-0Ц, интерлейкин-6 (ИЛ-6), резистин, ангиотензиноген, адипонектин и многие другие), обладают разнообразными влияниями на обменные процессы.
Эффекты адипокинов на регуляцию баланса энергии, чувствительности к инсулину, атеросклеротические процессы, уровень артериального давления, обмен глюкозы и липидов, в настоящее время активно исследуются.
Инкретины: теперь мы знаем о болезни больше
В последние годы большой научно-практический интерес вызывает изучение роли гормонов желудочно-кишечного тракта в регуляции секреции инсулина, а, следовательно, и в регуляции гомеостаза глюкозы в организме человека. Эти гормоны выделяются отдельными клетками желудочно-кишечного тракта, главным образом кишечника. Из них более или менее известна роль глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого-инсулинотропного полипептида (ГИП), которые получили название инкретины.
Инкретины – это гормоны желудочно-кишечного тракта, вырабатываемые в ответ на прием пищи и вызывающие стимуляцию секреции инсулина.
Их действие, приводящее к усилению глюкозозависимой секреции инсулина β-клетками поджелудочной железы было названо как «инкретиновый эффект». Кстати, «инкретиновый эффект» был впервые описан двумя независимыми исследовательскими группами (McIntyre, Elrick) еще в 1964 году, и трактовался как характеристика действия пептидных гормонов, которые секретируются К- и L – клетками кишечника в ответ на прием пищи. С его помощью можно объяснить механизм стимуляции выработки инсулина в ответ на прием пищи. Необходимо отметить, что наиболее изученным из группы инкретинов в настоящее время является ГПП-1. Он продуцируется специализированными L – клетками тонкого кишечника. Многочисленные экспериментальные работы продемонстрировали, что секреция ГПП-1 определяется качествами пищи, нервными и эндокринными факторами (Рис. 3) Следует отметить, что фоновый уровень ГПП-1 в плазме крови человека находятся в пределах от 5 до 10 пМоль, и повышаются после приема пищи в 10–20 раз. В исследованиях Kieffer Т. Y, 1999, Drucker D.J., 1998, Massimo S.P., 1998, было показано, что ГПП-1 секретируется в ответ на прием смешанной пищи и таких её составляющих, как глюкоза, жирные кислоты и пищевые волокна. Так, прием чистой глюкозы приводит к двухфазному увеличению ГПП-1 в плазме крови. Если же глюкозу вводить внутривенно, тогда увеличение уровня ГПП-1 оказывается минимальным (Hermann С., 1995). Графики демонстрируют изменения глюкозы и инсулина плазмы крови в ответ на пероральный прием и внутривенное введение глюкозы у здоровых людей (Рис. 1).

Рис. 1

Рис. 2

Рис. 3
Двухфазная секреция ГПП-1, вероятно, происходит за счет интеграции гормональных и рефлекторных факторов, которые стимулируют раннее выделение ГПП-1 (10–15 минут), а прямой пищевой контакт с L – клетками стимулирует вторую фазу (30‑60 минут) секреции ГПП-1 (Kieffer T. Y., 1999). Известно, что период жизни биологически активного ГПП-1 меньше, чем 2 минуты. Такой короткий период существования ГПП-1 в плазме обусловлен активностью фермента ДПП- IV (дипептидилпептидаза-IV), который, присутствуя во многих органах и тканях, довольно быстро инактивирует его (Рис. 2). Путь выведения ГПП-1 осуществляется через почки. В этой связи интерес представляют данные, что у пациентов с нарушением функции почек ГПП-1 в плазме крови оказывается повышенным.
Исследования показывают, что инкретины обладают множественными биологическими эффектами в отношении функции различных органов и тканей. Среди них наиболее важные: усиление секреции инсулина, торможение кислотной секреции желудка, увеличение частоты сердечных сокращений, ускорение усвоения глюкозы мышцами, усиление работы почек. ГПП-1, подавляя секрецию глюкагона, ограничивает повышение концентрации глюкозы в крови после приема пищи (Рис. 4).
Установлено, что инкретины способствуют регенерации островковых клеток поджелудочной железы, воздействуя на специфические белковые факторы роста (M. A. Nauck et al., 1997).
Имеются доказательства того, что ГПП-1 действует как вещество, повышающее чувствительность β-клеток к глюкозе. Так, ГПП-1 может способствовать образованию АТФ (аденозинтрифосфорной кислоты) в митохондриях клеточного ядра, что оказывает существенное влияние на энергетический обмен клетки. Важное клиническое значение имеет тот факт, что препараты сульфонилмочевины, которые связываются с АТФ-чувствительными калиевыми каналами и закрывают их, могут выключать зависимость ГПП-1 от глюкозы. Клинически важным является и тот факт, что ГПП-1 не может вызвать развитие выраженного снижения концентрации глюкозы в крови (кроме, возможно, случаев одновременного применения с препаратами сульфонилмочевины).

Рис. 4

Рис. 5
Недавно было показано, что ГПП-1 способен приостанавливать естественную гибель β-клеток. В связи с тем, что нормальное количество β-клеток поддерживается равновесием процессов программированной гибели (апоптоза) и воспроизводства (пролиферации), эти данные представляют огромный интерес. Они открывают возможность использования инкретинов при патологических состояниях, связанных с усиленной гибелью β-клеток поджелудочной железы. Можно предполагать, что ГПП-1 способен стимулировать образование новых β-клеток (неогенез) у пациентов с сахарным диабетом 2-го типа и недостаточным количеством функционирующих клеток.
Особый интерес представляют данные, касающиеся изучения секреции инкретинов при сахарном диабете 2-го типа. Toft-Nielsen, изучая секрецию ГПП-1 у больных сахарным диабетом 2-го типа, выявили существенные нарушения обмена этого этерогормона при данном заболевании. При сравнении секреции инсулина в ответ на внутривенную нагрузку или нагрузку глюкозой путём приёма внутрь, при условии одинаковой концентрации глюкозы, оказалось, что превышение секреции инсулина во втором случае у здоровых лиц достоверно выше, чем при сахарном диабете 2-го типа (Nauck, 1986). Говоря о нарушении инкретинового эффекта при сахарном диабете 2-го типа, важно подчеркнуть, что при этом заболевании секреция ГПП-1 снижена на 20–30 % при сохранении в целом его инсулиностимулирующего действия (Рис. 5).
Таким образом, становится совершенно очевидно, что новые данные об инкретинах имеют не только теоретическое, но и практическое значение. Новое и перспективное направление в лечении сахарного диабета 2-го типа основано на использовании инкретинового эффекта. Для этой цели уже созданы новые группы сахароснижающих препаратов, многие пациенты, в том числе и в России, в настоящее время получают терапию, основанную на коррекции инкретиновой системы.