1. ИОНИЗИРУЮЩИЕ ИЗЛУЧЕНИЯ И ИХ СВОЙСТВА
1.1. Физическая природа ионизирующих излучений
1.1.1. Материя, масса, энергия
Материя неразрывно связана с движением. Движение есть способ существования материи, внутреннее присущее ей свойство. Материя без движения так же немыслима, как и движение без материи. Все происходящие в мире процессы и изменения: перемещение частиц и распространение волн, электромагнитные и тепловые явления, химические и ядерные процессы, органическая жизнь и т. п. – являются формами движения материи.
Согласно современным физическим представлениям материя существует в двух основных видах: вещества и поля. Вещество и его элементы – частицы различной степени сложности (в том числе и элементарные частицы) – имеют собственную массу, или массу покоя, что, в частности, отличает вещество от поля (например, электромагнитного), которое массой покоя не обладает.
Современная физика различает следующие конкретные физические формы движения материи: механическую, тепловую, химическую, электромагнитную, ядерную. Дальнейшее расширение и углубление познания материи позволит, несомненно, раскрыть новые физические формы ее движения.
Разделение физических форм движения материи является в известной мере условным, так как фактически в природе ни одна физическая форма движения материи не существует изолированно от других ее форм движения. Однако для каждого рода физических объектов существует специфическая физическая форма движения материи, свойственная именно этому роду как главная форма движения.
Все физические формы движения материи обратимы, при этом в строго определенных количественных отношениях, что обусловило введение понятия энергии как общей меры движения материи.
В соответствии с различными физическими формами движения материи различают и виды энергии (механическая, тепловая, химическая и др.), которые также способны к взаимным превращениям в определенных количественных отношениях. Эта способность различных видов энергии к взаимным превращениям выражается законом сохранения и превращения энергии.
Из сказанного следует, что материи всегда присуща энергия и что не может быть энергии без материи.
Из закона сохранения и превращения энергии следует, что между различными видами энергии существует эквивалентность. Этот закон справедлив для всех видов энергии, он является всеобщим законом природы, не знающим исключений, и выражает языком физики единство материального мира.
Если материальная система подвергается внешним воздействиям, в результате которых она переходит из одного состояния в другое, то изменение ее энергии равно изменению энергии взаимодействующих с ней тел и полей. В термодинамике внешние воздействия подразделяются на два рода: механическую работу, совершаемую системой, и теплообмен между системой и внешней средой, характеризуемый количеством тепла, отдаваемого (или поглощаемого) системой. Соответственно этому закон сохранения и превращения энергии в термодинамике формулируется так: количество тепла Q, сообщенное системе, идет на увеличение внутренней энергии системы U и на совершение системой внешней работы А, т. е. Q = U + А.
Этот закон носит название первого начала (принципа) термодинамики.
В физике большое значение имеет взаимосвязь массы и энергии. Масса является одной из важнейших характеристик тел, одним из неотъемлемых свойств материи.
До конца XIX века масса считалась неизменным свойством частиц вещества, не зависящим от скорости их движения. Исследования и опыты по определению светового давления, опыты с быстро движущимися электронами показали, что их масса меняется вместе со скоростью.
В теории относительности этот закон был распространен на любые частицы вещества: атомы, нейтроны, электроны и др.
Масса тел и частиц, движущихся с большой скоростью (соизмеримой со скоростью света), будет больше массы покоя.
Эйнштейн в теории относительности вывел исключительно важную закономерность в соотношении между массой m и энергией Е тел (частиц), а именно E = mc2.
Это соотношение выражает закон взаимосвязи массы и энергии для любых тел, элементарных частиц и полей, подтверждая неразрывность движения и материи, оно подчеркивает общность всех видов энергии. Закон зависимости массы от скорости и закон взаимосвязи между массой и энергией получили экспериментальное подтверждение при ядерных реакциях, они имеют большое значение при расчетах ядерных процессов. Эти закономерности лежат в основе теории современной ядерной физики.
Так как с2 является величиной постоянной, то всякое изменение энергии тела влечет за собой соответствующее изменение его массы, следовательно, количество энергии тела может оцениваться и величиной его массы. Поэтому не должно представляться странным выражение: «Солнце ежеминутно излучает энергию в количестве, равном 250х106 т».
Все тела с одинаковой массой содержат одинаковое количество энергии. Чтобы оценить энергию 1 г любого тела (металла, угля, песка и др.), надо в соотношение Эйнштейна поставить вместо m единицу, а вместо с – значение скорости света (3х1010 см/с). Тогда, тело с массой 1 г обладает энергией, равной 9х1020 эрг или 2,15х1013 кал или 9х1013 Дж, что соответствует количеству энергии, выделяющейся при сжигании около 3000 т каменного угля.
Из показанного примера следует, что природа располагает неисчислимыми запасами энергии, даже малой части которых достаточно для удовлетворения потребностей в энергии всего человечества. Однако в настоящее время освобождение и использование этой энергии является пока еще сложной проблемой.
Прежде чем приступить к рассмотрению вопросов, связанных с количественным выражением значений энергии, предлагается рассмотреть единицы измерения энергии и их количественные соотношения, вытекающие из эквивалентности различных физических форм энергии (табл. 1.1).
Таблица 1.1
Соотношения между энергетическими единицами
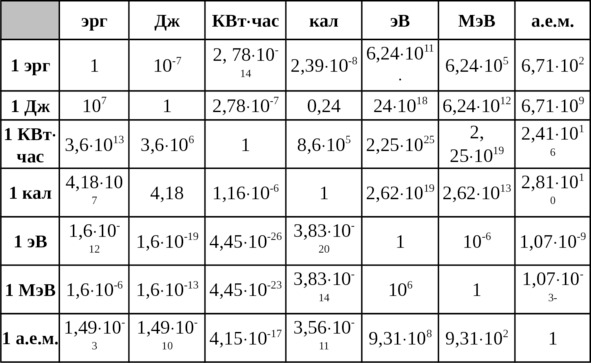
1кг массы вещества соответствует 5,61х1022 МэВ или 0,603х1024 а.е.м., а 1 а.е.м., в свою очередь, соответствует 1,66х10—27 кг массы вещества.
В качестве единицы измерения энергии элементарных частиц в атомной физике применяют электрон-вольт (эВ). Один электрон-вольт (1 эВ) – это такое количество энергии, которое приобретает электрон при перемещении в постоянном электрическом поле с разностью потенциалов 1 В. При этом, электрическое поле совершает работу перемещения электрона, в результате чего энергия электрического поля преобразуется в кинетическую энергию электрона.
Ввиду того, что электрон-вольт представляет очень малую величину, энергию элементарных частиц измеряют в мегаэлектрон-вольтах (МэВ) (1 МэВ=106 эВ). Мегаэлектрон-вольт – малая величина энергии: 1 МэВ=1,6х1013 Дж.
Электрон – стабильная элементарная частица, легчайшая из электрически заряженных материальных элементарных частиц. Электрон является также наименьшей частицей отрицательного электричества. Величина заряда электрона называется элементарным зарядом.
Важнейшими характеристиками элементарных частиц являются масса покоя (называемая также собственной массой) и электрический заряд. Масса покоя электрона mе=9,1095х10—31 кг, отрицательный электрический заряд его (элементарный электрический заряд) равен 1,6х10—19 Кл (кулон): 1 Кл – количество электричества, протекающего за 1 с через поперечное сечение проводника при силе тока 1 А.
Массы других частиц обычно выражают или в массах электрона, или в так называемых атомных единицах массы (а.е.м.).
За физическую атомную единицу массы принята 1/12 часть массы изотопа углерода 12С (1 а.е.м. = 1,66х10—27 кг, т.е. в 1824 раза больше массы покоя электрона (1 а.е.м.=1824 mе)).
1.1.2. Строение вещества
В настоящее время известно около 1,5х106 типов молекул. Однако атомов к началу 1964 г. было идентифицировано 101, из них в природе встречаются 88, а 13 получаются искусственно. Все известные молекулы построены примерно из 60 типов атомов.
Множество атомов одного типа называется химическим элементом. Таким образом, эти элементы являются теми «кирпичами», из которых сложены в многообразных комбинациях все тела окружающего нас материального мира – неорганического, органического, растительного и животного.
Атом является мельчайшей первичной частицей химического элемента. Он представляет собой сложную электродинамическую систему, состоящую из двух частей: небольшой очень плотной положительно заряженной центральной части, именуемой ядром, и легкой внешней (орбитальной) электронной оболочки, образованной отрицательно заряженными элементарными частицами – электронами. Атомные ядра представляют собой сложные образования, состоящие из элементарных материальных частиц – протонов с положительным электрическим зарядом и нейтронов, которые электрического заряда не имеют. Протоны и нейтроны носят общее название – нуклоны.
Ядро атома водорода (наиболее легкого из всех элементов) состоит из одного протона и не содержит нейтронов.
Протон – стабильная элементарная частица, обладающая положительным зарядом (ядро атома водорода). Масса протона в 1837 раз больше массы электрона (т. е. составляет 1837 mе или 1,00758 а.е.м.). Заряд протона равен по абсолютной величине заряду электрона, но противоположен ему по знаку, т. е. равен одной положительной элементарной единице заряда. Протон обозначается 11р, где индексы обозначают массу и заряд протона.
Нейтрон – это нейтральная частица. Масса нейтрона равна 1839 mе или 1,00893 а.е.м., то есть примерно равна массе протона. В свободном состоянии нейтрон – неустойчивая частица и претерпевает превращения. Нейтрон обозначается 10n, где индекс 0 – заряд нейтрона, индекс 1 – масса нейтрона.
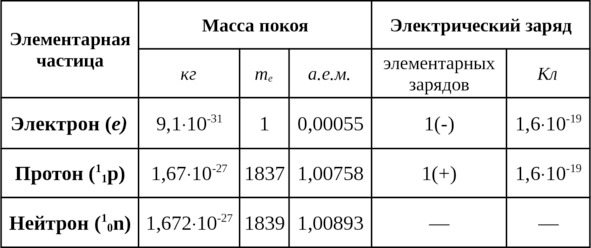
Таким образом, почти вся масса атома сосредоточивается в его ядре; масса электронной оболочки составляет сотые доли процента массы атома (см. табл. 1.2).
Таблица 1.2
Значения масс покоя и электрических зарядов элементарных частиц атома
При нормальном (невозбужденном) состоянии атома число электронов его оболочки равно числу протонов ядра, следовательно, атом электрически нейтрален. Отношение числа нейтронов к числу протонов в ядрах атомов (кроме ядра атома водорода) равняется приблизительно единице для легких ядер и постепенно возрастает до 1,6 с увеличением массы ядра.
В современной физике принято считать, что атомы имеют строение, напоминающее (геометрически) планетную систему Солнца. В центре электродинамической системы атома находится ядро, вокруг которого движутся по своим орбитам электроны. Геометрическая модель атома представлена на рис. 1.1.
Число положительных зарядов атомного ядра (число протонов) называется атомным номером Z элемента.
Число нуклонов (протонов и нейтронов) в ядре называют массовым числом А элемента A = N + Z,
где N – число нейтронов в ядре (N = А – Z).
Заряд ядра обусловлен наличием в нем протонов. Заряд любого ядра равен Q = Ze,
где е – заряд протона, Кл.
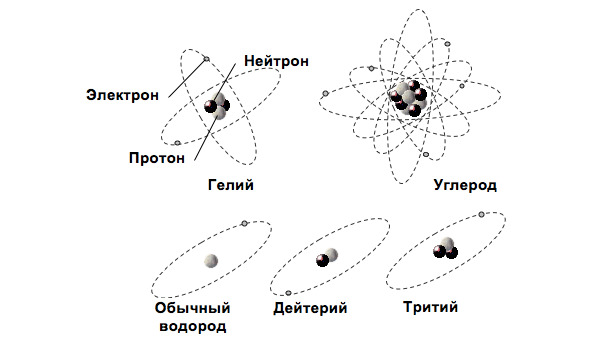
Рис. 1.1. Планетарная модель атома
По величине заряда ядра все химические элементы располагаются в определенной последовательности в соответствии с периодической таблицей элементов Менделеева. Порядковый номер элемента в этой таблице равен заряду его ядра.
Вид атомов с данными числами протонов и нейтронов в ядре называют нуклидом и обозначают символом элемента с указанием атомного номера (внизу слева) и массового числа (вверху слева), например, 42He – гелий с зарядом, равным двум зарядам электрона, и массовым числом, равным 4 (см. рис. 1.1).
Массовое число равно ближайшему целому числу, выражающему атомный вес элемента. Например, записи, характеризующие изотопы урана: 23892U, 23592U и 23392U, означают, что все эти изотопы имеют один атомный номер 92, числа же нейтронов их атомных ядер различны и соответственно равны: 238—92=146; 235—92=143 и 233—92=141.
Количество электронов в атоме равно количеству протонов в его ядре (см. рис.1.1). Электроны в атоме сгруппированы по электронным оболочкам (орбитам), номера которых возрастают по мере удаления от ядра: n=1,2,3,4… Суммарный отрицательный заряд всех орбитальных электронов равен суммарному положительному заряду протонов ядра. Атом в нормальном состоянии – электрически нейтральная система.
Энергия связи, благодаря которой электроны удерживаются в атоме, зависит от расстояния электрона до центра атома. Каждая орбита соответствует вполне определенному значению этой энергии.
Электроны, расположенные вблизи ядра, находятся под действием большей силы притяжения, чем электроны, находящиеся дальше от него. Когда электрон, оставаясь внутри атома, переходит с одной орбиты на другую, то выделяется или поглощается энергия. Электрон, переходя с ближней обриты на более удаленную от ядра, должен преодолеть силу притяжения ядра, т.е. приобрести (поглотить) дополнительную энергию. При переходе электрона с дальней орбиты на ближайшую к ядру происходит выделение энергии, которая может быть излучена атомом.
Атом, в котором электроны обращаются на более удаленной от ядра орбите, чем им дозволенной, называется возбужденным. Возбужденный атом неустойчив и время его жизни в этом состоянии: х 10—8 с.
Из периодической системы элементов видно, что атомы различных элементов имеют различное количество слоев (орбит) электронов. Оно зависит от атомного номера, который определяет положение (период) элементов в периодической системе. Наибольшее число слоев электронной оболочки равно семи.
Исходя из того, что атом представляет собой электродинамическую систему планетарной структуры, под диаметром атома понимают диаметр воображаемой сферы, заключающей в себе атом, внутрь которой не может проникнуть другой атом из-за действия сил отталкивания, возникающих между электронными оболочками (см. рис. 1.1). Диаметр атома около 10—8 см. Размеры атомных ядер очень малы; плотность же ядерного вещества чрезвычайно большая.
Диаметр ядра атомов различных элементов лежит в пределах 10—13 – 10—12 см, т. е. в 104 – 105 раз меньше диаметра атома. Радиус атомного ядра может быть определен по формуле R = 1,5 x 10—13xA1/3, где А – число нуклонов в ядре (массовое число).
Радиус атома приблизительно равен (2,5…5,5) х10—11м, а радиус атомного ядра (1,5—10) х10—16м. Так, радиус ядра атома 23892U составляет приблизительно 0,93х10—15м, а его объем —3,4х10—40м3.
Исходя из того, что масса каждого нуклона равна приблизительно 1 а.е.м. или 1,66х10—27кг, масса ядра урана равна приблизительно 395х10—27кг. Плотность ядерного вещества урана равна 116 000 кг/м3. Плотность ядерного вещества других элементов примерно такая же.
Из изложенного следует, что основная часть энергии атома сосредоточена в его ядре, на электронную же оболочку остается сравнительно ничтожная ее доля. Поэтому перспективным путем получения больших количеств промышленной энергии является деление атомных ядер, в результате которого выделяется ядерная энергия.
1.1.3. Изотопы. Радиоактивность и ее закономерности
Существует много атомов, ядра которых содержат равное число протонов, но разное число нейтронов. Массовые числа у этих атомов различны, но их химические свойства одинаковы, так как они имеют один и тот же заряд ядра и, следовательно, занимают одно и то же место в таблице Менделеева. Такие атомы получили название изотопов. Изотоп – нуклид с числом протонов в ядре, свойственным данному элементу.
Изотопный состав имеют многие химические элементы, некоторые из них имеют относительно большое количество изотопов. Например, водород имеет три изотопа: 11H – протий (легчайший изотоп водорода), 12D – дейтерий, 13T – тритий; известны: 19 изотопов йода, восемь изотопов железа, шесть изотопов урана и т. д.
Изотопы одного элемента химическими методами не могут быть разделены. Записываются изотопы элементов одинаковыми символами, отличающимися один от другого лишь массовым числом, например: изотоп углерода – от 106C до 146C; изотоп алюминия – от 2613Al до 2913Al; изотоп урана – от 23392U до 23992U и т. д.
Известно около 1500 изотопов. Одни из них устойчивые – стабильные, другие неустойчивые – радиоактивные. Стабильные изотопы – изотопы, ядра которых в течение длительного промежутка времени не претерпевают изменения. Изотопы, ядра которых со временем распадаются, называют радиоактивными или радионуклидами (РН). Радионуклид – нуклид, обладающий радиоактивностью. Радиоизотоп – изотоп, обладающий радиоактивностью.
В конце XIX в. А. Беккерелем, Пьером и Марией Кюри и другими учеными было открыто явление самопроизвольного распада ядер некоторых неустойчивых химических элементов. Исследователи установили, что распадающиеся ядра претерпевают превращения с образованием новых изотопов элемента и даже новых элементов, при этом выделяется энергия в виде радиоактивных излучений.
Радиоактивность – самопроизвольное превращение неустойчивого нуклида в другой нуклид, сопровождающееся испусканием ионизирующего излучения. Явление самопроизвольного распада ядер называется естественной радиоактивностью, а неустойчивые изотопы, претерпевающие самопроизвольные превращения, радиоактивными. Специально приготовленные радиоактивные изотопы называют искусственно радиоактивными.
Явление радиоактивности обладает рядом особенностей:
радиоактивность – свойство ядер радиоактивных элементов;
радиоактивность – самопроизвольный процесс;
на явление радиоактивности не влияют такие внешние факторы, как давление, температура, магнитные и электрические поля, химические реагенты;
в процессе радиоактивного распада выполняется закон сохранения энергии, согласно которому энергия материнского ядра равна энергии продуктов распада, закон сохранения электрического заряда и закон сохранения массы. Это означает, что суммарная энергия, масса и заряд до начала превращения и после его завершения должны оставаться постоянными.
Устойчивость атомных ядер обусловлена соотношением внутриядерных сил, воздействующих на нуклоны ядра. Такими силами являются:
ядерные силы взаимного притяжения нуклонов; эти силы проявляют себя на очень малых радиусах действия (не более 10—13см) и стремятся удержать ядро в целостности;
кулоновские силы взаимного отталкивания протонов, стремящиеся разрушить ядро.
Нормальный (невозбужденный) атом всякого элемента электрически нейтрален и все внутриатомные силы его находятся в равновесии.
Атомные ядра элементов с атомным номером 83 и более (число протонов Zх83, отношение числа нейтронов к числу протонов A—Z/Zх1,52) являются в той или иной мере неустойчивыми. К наименее устойчивым относятся ядра тяжелых элементов. На рис. 1.2 представлена графическая зависимость числа нейтронов в атомных ядрах элементов от заряда ядра.
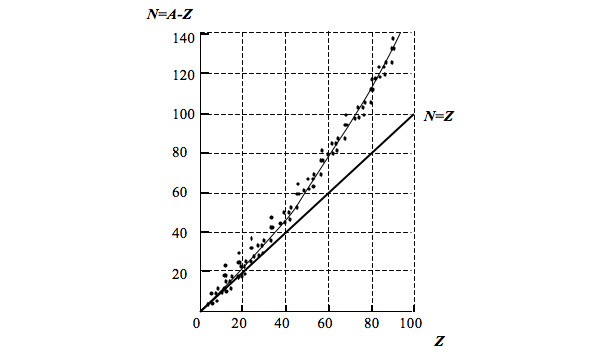
Рис. 1.2. Зависимость N (Z)
По мере увеличения числа протонов в устойчивых атомных ядрах число нейтронов, приходящихся на один протон, возрастает от 1 до 1,6. Это обусловлено тем, что с увеличением числа протонов в ядре кулоновские силы отталкивания усиливаются и, преодолевая ядерные силы взаимного притяжения нуклонов, стремятся разъединить и удалить протоны из ядра.
Ядро с большим числом протонов может существовать только при наличии большого числа нейтронов, которые, снижая концентрацию протонов в ядре (см. рис. 1.2), уравновешивают внутриядерные силы ядра атома. В устойчивых ядрах должно быть определенное соотношение числа нейтронов к числу протонов, увеличивающееся с возрастанием атомных номеров химических элементов.
Отклонение от этого соотношения приводит к неустойчивости элементов, т.е. к их радиоактивному распаду.
Распад ядер радиоактивных элементов происходит до тех пор пока не будет установлено равновесие нуклонов в ядре и ядро не станет устойчивым. Цепь распадов с последовательным образованием ряда промежуточных изотопов, называемая радиоактивным семейством, заканчивается нераспадающимся (стабильным) изотопом какого-либо элемента. Так, например, одно из таких радиоактивных семейств начинается ураном и заканчивается стабильным изотопом свинца.
В науке и технике широко используются искусственные радиоактивные изотопы, которые изготовляются путем различных ядерных реакций и превращений.
Между естественной и искусственной радиоактивностями одинаковых изотопов нет разницы, так как свойства радиоактивного изотопа не зависят от способа его получения.
Основными видами радиоактивных превращений атомных ядер являются: альфа-распад; бетта- и бетта+-распад, электронный захват (К-захват); гамма-распад; нейтронный распад (n-распад); спонтанное деление ядер.
При альфа-распаде из ядра распадающегося элемента излучается альфа-частица, представляющая собой ядро атома гелия 42He (два протона и два нейтрона) и имеющая положительный заряд, равный по абсолютной величине двум зарядам электрона. В настоящее время известно около 40 естественных и более 200 искусственных альфа-активных ядер. Этот вид распада характерен для тяжелых элементов, обладающих меньшими значениями энергии связи, и нередко сопровождается гамма-излучением. Образовавшееся при альфа-распаде дочернее ядро будет иметь заряд и массу, меньшие, чем у распавшегося ядра, соответственно на две и четыре единицы. В общем виде реакция альфа-распада записывается так AZX – A-4Z-2Y +42He + Q, где Q – выделившаяся при распаде энергия, эВ.
Например, ядро плутония 23994Pu, излучив альфа-частицу, превращается в ядро урана 23592U. Общая схема этого альфа-распада приведена на рис. 1.3. Процесс альфа-распада принято представлять следующим образом. В результате взаимодействия ядерных и кулоновских сил в некоторый момент ядро отделяет альфа-частицу, которая вскоре оказывается под действием только отталкивающих кулоновских сил. Эти силы разгоняют альфа-частицу до скорости, достигающей на периферии атома 20000 км/с. Отдельная частица приобретает большую кинетическую энергию. Таким образом, выбрасыванием из ядра альфа-