Глава 1 Семиотика и диагностика соматических заболеваний у детей
Общая семиотика
Основополагающими методами постановки диагноза многих заболеваний и оценки особенностей их лечения являются тщательно и целенаправленно собранный анамнез и систематически проведенное клиническое обследование больного ребенка.
Данные лабораторных анализов и инструментального обследования (рентгенологического, эндоскопического, электрокардиографического, ультразвукового и др.) позволяют подтвердить диагноз и более полно представить развитие заболевания.
Диагностические возможности лабораторных и инструментальных методов обследования постоянно расширяются, увеличивается объем получаемой информации, но их результаты должны оцениваться только в сопоставлении с данными клинического обследования, полученными при личном контакте врача с пациентом.
Анамнез
Анамнез включает в себя жалобы больного, историю начала и развития настоящего заболевания, историю роста и развития ребенка, историю семьи и условия жизни ребенка.
В анамнезе заболевания должны быть сведения о том, когда заболел ребенок, при каких обстоятельствах и как развилось заболевание, как протекало, какие были жалобы, какие были проявления заболевания (повышение температуры тела, озноб, сыпь, одышка, рвота, беспокойство и др.), и их изменения в динамике. Если ребенок получал лечение, то какие лекарственные препараты, в течение какого времени (особенно это важно уточнить в отношении применения антибиотиков, гормональных препаратов, мочегонных средств), их эффективность и возможные нежелательные последствия (аллергические реакции и др.).
Анамнез жизни включает сведения о родителях (возраст, состояние здоровья, условия жизни и др.), периоде новорожденности, грудном, дошкольном, школьном периодах. Чем младше ребенок, тем обычно более детально выясняются подробности раннего детства. Для характеристики периода новорожденности выясняют особенности течения беременности, родов, показатели физического развития новорожденного, сроки отпадания пуповины, закрытия пупочной ранки и др. При характеристике грудного периода большое внимание уделяется вскармливанию ребенка, психомоторному и физическому развитию. В анамнезе жизни детей старшего возраста желательно отразить особенности их поведения дома, в коллективе, успеваемость в школе, занятия физкультурой, спортом.
Подробно выясняются данные о перенесенных заболеваниях, особенностях их течения, лечения, наличие экссудативного диатеза и других проявлений аллергии, сведения о профилактических прививках, их сроках, реакции на них, о туберкулиновых пробах и их результатах.
Выясняются условия жизни ребенка, наличие неблагоприятных факторов (недостаточное пребывание на воздухе, длительный просмотр телепередач, нерегулярное питание, курение родителей и др.).
При ряде заболеваний необходим генеалогический анамнез.
Объективное обследование
Объективное обследование включает данные, полученные при осмотре, пальпации, перкуссии, аускультации. Начинается оно с оценки самочувствия и состояния больного.
Оценка самочувствия осуществляется путем расспроса матери или ребенка о беспокоящих его болях, других неприятных ощущениях, о сне, аппетите. Самочувствие может быть расценено как вполне удовлетворительное или неудовлетворительное.
Заключение о состоянии больного дается не только на основании оценки его самочувствия, но, главным образом, на основании данных, полученных при клиническом, лабораторном и инструментальном обследованиях. Состояние может быть расценено как удовлетворительное, средней тяжести, тяжелое и терминальное.
Обследование ребенка любого возраста включает оценку его физического и психомоторного развития.
Если больной находится в постели, обращают внимание на его положение. При некоторых заболеваниях дети принимают вынужденное положение (при тяжелом приступе бронхиальной астмы, выраженной недостаточности кровообращения больные лучше себя чувствуют в положении сидя с опущенными ногами).
Осмотр необходимо начать с оценки состояния кожных покровов и слизистых оболочек губ, полости рта, языка. Окраска кожных покровов, наличие сыпи, кровоизлияний, отеков и других патологических проявлений имеют большое значение в диагностике многих заболеваний.
Кожа здорового ребенка бледно-розового цвета, мягкая, эластичная.
Бледность кожи – один из частых симптомов, наблюдаемых при многих заболеваниях – анемии, интоксикации, сердечно-сосудистой патологии, вегетососудистой дистонии и др.
Цианоз кожи – синеватый или синий цвет кожи, возникающий при уменьшении насыщения гемоглобина кислородом. Наблюдается при нарушении легочной вентиляции (пневмония, инородные тела в дыхательных путях, круп, бронхиальная астма и др.), наличии патологических шунтов между правым и левым отделами сердца, между артериями и венами, при которых венозная кровь попадает в артериальное русло, минуя легкие (врожденные пороки сердца – тетрада Фалло, общий артериальный ствол и др.), сердечно-сосудистой недостаточности, увеличении концентрации гемоглобина в крови (полицитемия).
Слабовыраженный цианоз у детей первых месяцев жизни лучше всего виден в области стоп, пяток, ногтевых фаланг.
Желтушное окрашивание кожи возникает вследствие повышенной концентрации билирубина в крови, сочетается с желтушным окрашиванием склер. Наблюдается при гемолизе эритроцитов (гемолитических анемиях), заболеваниях печени (гепатиты, циррозы, атрезия желчевыводящих путей у новорожденных, закупорка желчных протоков камнями, глистами и др.).
Сыпи наблюдаются при многих инфекционных заболеваниях (скарлатина, корь, краснуха, ветряная оспа). При каждом заболевании имеют характерный вид, локализацию, последовательность высыпаний. Аллергические высыпания – крапивница, кольцевидная сыпь и др. Геморрагические сыпи – мелкоточечные – петехии, более крупные – экхимозы. Птехиальная сыпь типична для болезни Шенлейна – Геноха и менингококцемии, экхимозы появляются при болезни Верльгофа.
Отеки наблюдаются в коже и подкожной клетчатке. Могут быть общими (генерализованными) и локальными. Образование отеков связано с увеличением количества внеклеточной, внесосудистой жидкости. Отеки выявляются при осмотре визуально (в виде припухлостей кожи), пальпаторно (повышение плотности отечного участка кожи, при надавливании на него пальцем появляется ямка, которая очень медленно исчезает).
Общие отеки наблюдаются при сердечной недостаточности, заболеваниях почек. Локальные отеки, довольно плотные, наблюдаются при системной склеродермии; аллергический локальный отек Квинке, местные отеки – после укусов насекомых, змей; отек шеи – при токсической дифтерии и др.
Губы здорового ребенка ярко-розового цвета. При анемии они становятся бледными, при кислородном голодании (пневмонии, врожденных пороках сердца, сердечной и сосудистой недостаточности) – цианотичными, при интоксикациях и обезвоживании – ярко-красными, сухими, с трещинами.
Слизистая оболочка ротовой полости у здоровых детей розового цвета, блестящая. У детей грудного возраста наблюдаются поражение слизистой оболочки грибом Oidium albicans и развитие молочницы – появление многочисленных величиной с булавочную головку белых налетов, возвышающихся над уровнем слизистой оболочки и плотно прилегающих к ней. Мелкие налеты сливаются между собой и покрывают сначала отдельные участки, а затем всю слизистую оболочку языка, губ, десен, щек.
При осмотре языка обращают внимание на его величину, состояние слизистой оболочки, наличие налета.
Патологическое увеличение массы языка – макроглоссия – наблюдается при гипотиреозе, болезни Дауна.
Обложенность языка появляется при всех заболеваниях, сопровождающихся лихорадкой, заболеваниях желудочно-кишечного тракта, сухой язык – при обезвоживании.
При осмотре нёбных миндалин определяют их величину, наличие воспаления миндалин – ангины или тонзиллита. При катаральной ангине слизистая оболочка миндалин и дужек гиперемирована, миндалины нерезко увеличены. При фолликулярной ангине миндалины увеличены, гиперемированы, под слизистой оболочкой видны округлой формы желтовато-белые точки. При лакунарной ангине видны желтовато-белые налеты, повторяющие ход лакун. При фибринозной ангине миндалины сплошь покрыты беловато-желтым налетом. Флегмонозная ангина развивается при переходе воспаления на околоминдалиновую клетчатку. Процесс чаще односторонний, миндалина и окружающие ткани резко гиперемированы, отечны, открывание рта затруднено, резкие боли при глотании с иррадиацией в ухо, нижнюю челюсть.
Исследование функции сердечно-сосудистой системы следует начинать с обязательного определения пульса на обеих руках (на лучевой артерии) и ногах (на бедренной артерии), его частоты (табл. 1), характера (слабый, напряженный), формы (высокий, быстрый или медленный).
Таблица 1
Частота пульса у детей (А. Ф. Тур, 1955)

Учащение пульса – тахикардия – может быть физиологическим и наблюдаться при эмоциональном напряжении (радость, страх), физической нагрузке, в жаркую погоду, после еды. Патологическая тахикардия возникает при многих заболеваниях (лихорадка, анемия, сердечная недостаточность, тиреотоксикоз).
Урежение пульса – брадикардия – может наблюдаться у здоровых детей (во сне, у спортсменов) и при ряде заболеваний (аритмии, гипотиреоз и др.).
Аритмический пульс характеризуется различными временны́ми интервалами между пульсовыми ударами и наблюдается при экстрасистолии и др.
Артериальное давление измеряют на руках, по показаниям – на ногах. Полученные результаты сопоставляют с нормативами (табл. 2).
На величину артериального давления, измеряемого по методу Короткова, влияют ширина и длина манжеты – она должна покрывать 2/3 плеча, и длина ее должна быть в 1,5 раза больше окружности плеча.
Повышение артериального давления – гипертензия – у детей чаще вторичного характера и является симптомом какого-либо заболевания (заболевания сердечно-сосудистой системы, почек и др.). Повышение артериального давления на руках и понижение его на ногах – ведущий симптом коарктации аорты.
Таблица 2
Нормативные показатели артериального давления у детей (по данным аускультативного метода Короткова)

Снижение артериального давления – гипотензия (гипотония) – наблюдается при вегетососудистой дистонии, миокардитах, острой сердечной и сосудистой недостаточности.
При осмотре грудной клетки обращают внимание на ее конфигурацию, которая зависит от конституциональных особенностей телосложения, занятий физкультурой, спортом, состояния органов дыхания. С учетом конституции детей различают три формы грудной клетки: нормостеническую, гиперстеническую и астеническую.
Нормостеническая форма – пропорциональное развитие грудной клетки, коэффициент отношения переднезаднего диаметра к поперечному составляет 0,6–0,8. Плечи расположены горизонтально.
Гиперстеническая форма – грудная клетка имеет округлую форму, переднезадний диаметр увеличен, нижняя апертура больше верхней, ребра отходят от позвоночника почти под прямым углом, эпигастральный угол тупой.
Астеническая форма – грудная клетка имеет уплощенный вид, плечи покаты, лопатки неплотно прилегают к грудной клетке, иногда значительно выступают (крыловидные лопатки), эпигастральный угол острый.
Осмотр грудной клетки позволяет выявить ее деформации. Выбухание в области сердца – «сердечный горб» – абсолютный признак органического поражения сердца. Воронкообразная деформация выражается в значительном западении нижней части грудины, представляет собой врожденную аномалию развития, наблюдается при синдроме Марфана, различных дисплазиях.
Важным диагностическим признаком является наличие патологических пульсаций: эпигастральная – при перегрузке правых камер сердца; в области яремной ямки – при увеличении сердечного выброса в аорту или препятствии току крови в аорте; пульсация и расширение шейных вен – при увеличении кровонаполнения правого предсердия или затруднении оттока крови из него.
При пальпации грудной клетки можно оценить голосовое дрожание, оно лучше определяется, если ребенок произносит букву «р», у грудных детей – при плаче, крике. Усиление голосового дрожания происходит при уплотнении легочной ткани (сливных пневмониях) и при образовании полостей в легких. Ослабление его наблюдается при выпотных плевритах, пневмотороксе, отеках и др.
Пальпируя грудную клетку, можно выявить подкожную эмфизему – появляется характерное похрустывание.
Пальпация области сердца начинается с определения верхушечного толчка, его локализации, силы, распространенности. Верхушечный толчок появляется вследствие передачи на переднюю грудную стенку систолического удара сердца, и у многих детей он виден на глаз. В норме он совпадает с левой границей сердца, локализован, средней силы. Усиленный толчок приподнимает палец, пальпирующий толчок. Средней силы толчок можно легко найти, но палец он не приподнимает. Если толчок ослаблен, его нужно искать. Локализованный толчок пальпируется в одном межреберье, разлитой – в двух или более межреберных промежутках. Разлитой усиленный верхушечный толчок наблюдается при гипертрофии правого желудочка; усиленный, смещенный вниз – при гипертрофии левого желудочка.
При пальпации определяют дрожание грудной клетки – систолическое, совпадающее с фазой систолы желудочков, диастолическое – с фазой диастолы, систолодиастолическое. Наличие дрожания является абсолютным признаком порока сердца.
Перкуссия границ сердца. Границы относительной сердечной тупости в норме образованы: верхняя – левым предсердием и легочным стволом; левая – левым желудочком; правая – в основном правым предсердием (табл. 3). Для избежания ошибок при перкуссии сердца необходимо строго придерживаться определенных линий, по которым проводится исследование границ; левой парастернальной линии – для верхней границы; IV или V межреберного промежутка – для левой границы.
Аускультация сердца обязательно производится в четырех классических точках: в области верхушки сердца, в III межреберье слева от грудины (точка Боткина), во II межреберье слева и справа от грудины. По возможности выслушивают сердце в положении ребенка лежа и стоя (или сидя).
Таблица 3
Перкуторные границы относительной сердечной тупости у детей

При аускультации оценивают тоны и шумы сердца. В норме выслушиваются I и II тоны.
I тон образуется из следующих основных компонентов: клапанного (захлопывание и вибрация створок двух– и трехстворчатого клапанов), мышечного (сокращение желудочков и напряжение миокарда в начале систолы), сосудистого (вибрация стенок аорты и легочной артерии вследствие растяжения излившейся в них крови).
II тон образуется в результате захлопывания клапанов аорты и легочной артерии.
В норме I тон на верхушке громче II тона. II тон на легочной артерии (во II межреберье слева) нерезко акцентирован, то есть выслушивается громче, чем на аорте (во II межреберье справа от грудины), этот физиологический акцент определяется у детей до 10–12–14 лет.
Ослабление I тона на верхушке наблюдается при миокардите или недостаточности митрального клапана, усиление его («хлопающий» тон) – при митральном стенозе, дефекте межпредсердной перегородки.
Патологический акцент II тона на легочной артерии – признак гипертензии в малом круге кровообращения; ослабленный II тон свидетельствует об уменьшении кровотока в легких (при стенозе легочной артерии и др.).
Изменение формы сердечных тонов проявляется в виде их раздвоения или расщепления. Если оба звука, составляющих тон, хорошо различимы – это раздвоение, если оба компонента тона различаются неотчетливо – это расщепление.
Дополнительные тоны сердца – III и IV – иногда выслушиваются в диастоле в виде очень тихого звука. Усиление III и IV тонов сердца воспринимается как ритм «галопа», наблюдается при тяжелых кардитах, сердечной недостаточности.
Шумы в сердце делятся на органические – обусловленные анатомическими дефектами клапанов, клапанных отверстий или структур сердца; функциональные – возникающие при повреждении мышцы сердца в результате воспаления, интоксикации, обменных нарушений, нарушения тонуса вегетативной нервной системы, а также «сопровождающие» шумы, возникающие при тяжелых патологических процессах в сердце и обусловленные несоответствием между значительно увеличенной полостью и функцией клапанного аппарата (шумы Грехема – Стилла, Флинта, Кумбса); акцидентальные – многочисленная группа шумов, наблюдаемых у совершенно здоровых детей, причина которых не всегда ясна; экстракардиальные – не связанные с движением крови (шум трения перикарда, кардиопульмональные шумы).
При наличии шума определяют его происхождение (систолический, диастолический, систолодиастолический), интенсивность, тембр, проводимость в границах сердца и за его пределами, изменение его в зависимости от положения тела (лежа, стоя) и от физической нагрузки.
Данные аускультации уточняют с помощью фонокардиографии и эхокардиографии.
При обследовании ребенка всегда необходимо определить частоту, глубину и ритм дыхания. В состоянии покоя здоровый взрослый человек делает 12–18 дыхательных движений в 1 минуту. У детей частота дыханий с возрастом изменяется (табл. 4).
Таблица 4
Частота дыхания у детей (А. Ф. Тур, 1955)

На одно дыхание у новорожденного приходится 2,5–3 сокращения сердца. У более старших детей – 3,5–4.
Ритм дыхания у детей первых месяцев жизни неустойчив.
Дыхательный цикл состоит из вдоха и выдоха.
Вдох осуществляется вследствие сокращения дыхательной мускулатуры, при этом увеличивается объем грудной клетки, альвеолы расширяются, и в них возникает отрицательное давление. Пока существует разница давлений между альвеолами и атмосферой, воздух поступает в легкие. В момент перехода от фазы вдоха к фазе выдоха альвеолярное давление равно атмосферному.
Выдох осуществляется главным образом за счет эластичности легких. Давление в альвеолах становится выше атмосферного, и эта разница давлений является движущей силой выдоха. Регуляция акта дыхания осуществляется нервно-гуморальным путем.
Одышка – диспноэ – нарушение частоты, глубины и ритма дыхания. Диспноэ может быть с преобладанием фазы вдоха (инспираторная одышка) или выдоха (экспираторная одышка) или без отчетливого их преобладания (смешанная одышка). Крайняя степень одышки носит название удушья.
При одышке можно наблюдать ряд симптомов, отражающих нарушение разных фаз дыхания.
Напряжение и раздувание крыльев носа свидетельствуют об участии вспомогательных мышц во вдохе, предотвращающем сужение входа в нос вследствие всасывающего действия струи вдыхаемого воздуха; втяжение яремной ямки, надключичных областей, межреберных промежутков – при затруднении вдоха, вследствие сужения дыхательных путей на любом уровне.
При затруднении выдоха межреберные промежутки уплощаются или даже могут выбухать.
Учащенное дыхание – тахипноэ, урежение дыхания – брадипноэ.
Глубина дыхания – объем вдыхаемого при каждом вдохе воздуха. Увеличение глубины дыхания – гиперпноэ — появляется при тяжелой анемии и коме. Поверхностное дыхание – гипопноэ – может быть обусловлено болевыми ощущениями при вдохе (при сухом плеврите).
Свистящее дыхание возникает при затрудненном вдохе и связано с вибрацией просвета крупных бронхов вследствие выраженного падения внутрибронхиального давления при высокой скорости прохождения струи воздуха по бронхам (при бронхоспазме).
Стонущее дыхание возникает при затруднении вдоха вследствие снижения растяжимости легкого и болевых ощущений (при массивной пневмонии, плеврите).
Патологическое периодическое дыхание характеризуется групповым ритмом, нередко чередующимся с апноэ или вставочными периодическими вдохами: дыхание Чейна – Стокса – при нем постепенно нарастает и снижается глубина дыхания, затем наступает пауза; дыхание Биота – при постоянной амплитуде дыхания имеется чередование дыхательных движений и продолжительных пауз (до 20–25 секунд); дыхание Куссмауля («большое дыхание») – шумное медленное или учащенное глубокое дыхание с вовлечением вспомогательной мускулатуры, без ощущения удушья.
У детей дыхание Чейна – Стокса и Биота наблюдается при тяжелых повреждениях головного мозга в результате травмы, интоксикации, ишемии, дыхание Куссмауля – при диабетической коме и других крайне тяжелых состояниях, сопровождающихся развитием метаболического ацидоза, при тяжелом неврозе.
Одним из частых симптомов, наблюдаемых при заболеваниях органов дыхания, является кашель.
Кашель – рефлекторный процесс удаления содержимого дыхательных путей с помощью струи воздуха, выбрасываемой с высокой скоростью из легкого благодаря серии форсированных выдохов, совершаемых против сопротивления спазмированных голосовых связок.
Сухой кашель возникает при раздражении слизистой оболочки трахеи, бронхов без значительного количества секрета.
Влажный кашель сопровождается выделением мокроты – секрета слизистой оболочки дыхательных путей, в котором могут содержаться микробы, гной, кровь и другие включения. После отделения мокроты кашель обычно прекращается.
Коклюшеподобный кашель – навязчивый, кашлевые толчки следуют один за другим, но, в отличие от коклюшного кашля, не сопровождается репризами, возникает при наличии вязкой мокроты.
Битональный кашель – первый кашлевой толчок низкий, второй имеет высокий тон, наблюдается при сдавлении бронха, наличии инородных тел в крупных бронхах.
Перкуссия грудной клетки позволяет определить границы легких, подвижность легочных краев, уровень стояния диафрагмы, а также уплотнение легочной ткани и наличие эмфиземы.
Нижняя граница легких располагается на следующем уровне: справа по сосковой линии – VI ребро, по среднеподмышечной линии – VIII ребро, по лопаточной линии – IX и X ребра. Слева легкое огибает сердце, отходит от грудины на уровне IV ребра; по среднеподмышечной линии – IX ребро, по лопаточной – X ребро. По околопозвоночной линии граница справа и слева на уровне остистого отростка XI грудного позвонка.
Для диагностики поражения легких большое значение имеет определение границ долей легкого, которые проецируются на грудную клетку следующим образом: сзади справа и слева над spina scapule проецируется верхняя доля, ниже ее – нижняя, спереди справа выше IV ребра – верхняя, ниже – средняя, слева под IV ребром – нижняя. В аксиллярной области справа определяются все три доли: до IV ребра – верхняя, между IV и VI ребрами – средняя, ниже VI ребра – нижняя.
О подвижности легочных краев можно судить, определяя нижнюю границу легких на вдохе и на выдохе. Уменьшение подвижности легочных краев наблюдается при эмфиземе, отеке легких, пневмотораксе и др.
Для определения локализации легочных поражений наряду с делением легких на доли важно знать сегментарное строение легких. Бронхолегочным сегментом называется участок легочной паренхимы, более или менее полно отделенный от соседних сегментов соединительно-тканными перегородками и снабженный самостоятельным бронхом и ветвью легочной артерии. В правом легком различают 10 сегментов, в левом легком – 9.
Верхние левая и правая доли делятся на три сегмента: верхневерхушечный – 1; верхнезадний – 2; верхнепередний – 3. Средняя доля справа делится на два сегмента: среднебоковой – 4; среднепередний – 5. В левом легком средней доле соответствует язычковая, также состоящая из двух сегментов: верхнеязычкового – 4; нижнеязычкового – 5. Нижняя доля правого легкого делится на пять сегментов: базально-верхушечный – 6; базально-медиальный – 7; базально-передний – 8; базально-боковой – 9; базально-задний – 10. Нижняя доля левого легкого делится на четыре сегмента: базально-верхушечный – 6; базально-передний – 8; базально-боковой – 9; базально-задний – 10 (рис. 1).
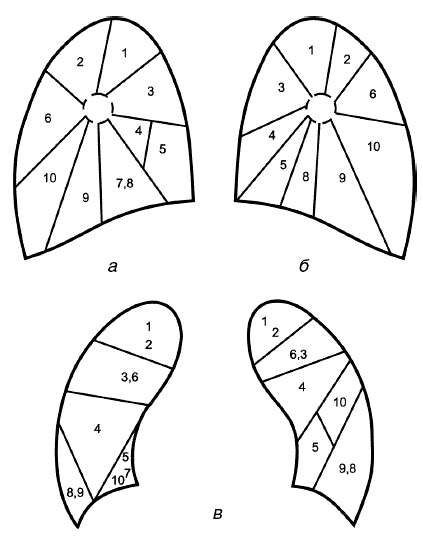
Рис. 1. Сегментарное строение легких: а – правое легкое (вид сбоку); б – левое легкое (вид сбоку); в – правое и левое легкие (вид спереди)
В норме при перкуссии определяется ясный легочный звук. Притупление или тупой легочный звук свидетельствует о наличии уплотненной легочной ткани (при крупозной, сегментарной пневмониях, ателектазе и др.) или о накоплении жидкости в плевральной полости. Коробочный оттенок перкуторного звука (тимпанит) возникает при повышении воздушности легких и наблюдается при эмфиземе. Ограниченные участки тимпанического звука определяются над полостью абсцесса, каверны.
Аускультация. При выслушивании легких определяются дыхательные шумы, обусловленные колебаниями альвеолярных стенок, голосовых связок и воздухоносных путей при прохождении по ним воздуха. У детей в зависимости от анатомо-физиологических особенностей органов дыхания в разные возрастные периоды характер дыхательных шумов меняется. У детей до 3–5 лет дыхание пуэрильное – при нем хорошо прослушиваются дыхательные шумы на вдохе и на выдохе. У более старших детей дыхание везикулярное – дыхательный шум мягкий, хорошо выслушивается на вдохе и быстро затухает на выдохе.
Ослабленное вазикулярное дыхание возникает при уменьшении или прекращении расправления легочных альвеол во время вдоха. Оно выслушивается при резком сужении воздухоносных путей в результате выраженного отека слизистой оболочки гортани, трахеи, при прекращении доступа воздуха в долю или сегмент легкого из-за наличия инородного тела в бронхе, сдавления бронха опухолью или воспалительным инфильтратом в начальной фазе бронхопневмонии, при нарушении эластичности легочной ткани в начале крупозной пневмонии, при выраженной эмфиземе легких (при астматическом статусе), при большом скоплении жидкости в плевральной полости.
Жесткое дыхание – дыхательные шумы хорошо прослушиваются на вдохе и на выдохе (при бронхитах, бронхопневмонии).
Бронхиальное дыхание – при нем выдох слышен всегда сильнее и продолжительнее, чем вдох. У здоровых детей оно выслушивается над гортанью, трахеей. При патологических состояниях оно появляется при выраженном уплотнении легочной ткани (лобарные пневмонии в стадии инфильтрации и др.).
Амфорическое дыхание – своеобразный характер бронхиального дыхания над крупными полостями в легких.
Хрипы – дыхательные шумы, возникающие в бронхах при наличии в них экссудата, выслушиваются в фазу вдоха и выдоха. Различают сухие и влажные хрипы. Сухие свистящие хрипы образуются в мелких и средних бронхах, сухие жужжащие хрипы возникают в крупных бронхах. Причинами сухих хрипов являются неравномерное сужение бронхов, шероховатости в воздухоносных путях, наличие в просвете бронха вязкого секрета.
Влажные хрипы возникают при наличии в бронхах большого количества слизи, отечной жидкости или крови. В зависимости от места образования их делят на крупно-, средне– и мелкопузырчатые.
Самые мелкие хрипы, образующиеся в бронхиолах, называются крепитирующими. Крепитация возникает только во время вдоха и зависит от разлипания альвеол, когда в них наряду с воздухом содержится небольшое количество жидкости. Крепитация характерна для начальной стадии лобарной пневмонии, начинающегося отека легкого и др.
Шум трения плевры появляется при патологических изменениях плевры – шероховатости поверхности, фибринозных наложениях. Он имеет характерное звучание, напоминающее шорох бумаги или скрип снега под ногами, выслушивается при сухом плеврите, выпотном плеврите в периоде рассасывания жидкости.
При аускультации легких необходимо соблюдать следующие правила: прослушивание предпочтительно проводить в положении сидя или стоя, так как эти положения обеспечивают равномерное участие легких в акте дыхания; проводить сравнительное выслушивание правого и левого легкого над симметрично расположенными участками; на одном месте совершенно необходимо выслушивать вдох и выдох.
Исследование органов пищеварения начинается с расспроса ребенка (родителей) о жалобах на боли в животе, нарушение аппетита, различные диспепсические расстройства (отрыжка, изжога, тошнота, рвота, характер и частота стула).
Осмотр живота в положении лежа дает возможность увидеть участие брюшной стенки в акте дыхания. При разлитом перитоните передняя брюшная стенка не участвует в дыхании.
В норме передняя брюшная стенка и грудь составляют одну плоскость. Увеличение живота в объеме наблюдается при ожирении, метеоризме, асците, значительном увеличении печени, селезенки, аномалии развития кишечника, западение брюшной стенки – при остром перитоните, туберкулезном менингите. Выраженная венозная сеть на передней брюшной стенке у детей старше 1 года свидетельствует о портальной гипертензии (внутрипеченочной – при циррозе печени, внепеченочной – при тромбозе в системе v. porte).
Пальпация живота начинается с поверхностной пальпации брюшной стенки, при этом определяется напряжение живота (defans muskulaire) – мышечная защита, которая является висцеромоторным рефлексом при воспалении брюшины (перитоните, аппендиците, прободной язве).
При глубокой пальпации в левой подвздошной области обычно удается прощупать сигмовидную кишку, в правой подвздошной области – слепую кишку. Поперечную ободочную кишку можно пропальпировать по обе стороны от срединной линии живота на 2–3 см выше или ниже пупка. У здоровых детей она прощупывается в виде мягкого цилиндра. Глубокой пальпацией иногда удается прощупать большую кривизну желудка слева на уровне или несколько выше пупка.
Печень у детей, особенно младшего возраста, относительно велика. До 5–7-летнего возраста печень выступает из-под края реберной дуги по среднеключичной линии на 1–2 см, нижний край ее безболезненный, острый и мягкоэластичный. Увеличение печени наблюдается при гепатитах, циррозах, недостаточности кровообращения (застойная печень), интоксикациях. Уменьшение размеров печени, особенно острое – при острой дистрофии печени (вирусном гепатите).
Резкая болезненность, возникшая при пальпации печени, свидетельствует о перегепатите (при переходе воспалительного процесса на капсулу) или о быстром растяжении капсулы печени (при острой сердечной недостаточности, вирусном гепатите).
Желчный пузырь у здоровых детей не пальпируется, но при холецистите, холангите обнаруживается значительная болезненность в области его проекции (нижний край печени кнаружи от латерального края правой прямой мышцы живота).
Аускультация брюшной полости применяется при подозрении на непроходимость кишечника. Усиление кишечных шумов наблюдается при инвагинации, отсутствие кишечных шумов (полное отсутствие перистальтики) – при атонии кишечника при перитоните.
У здоровых детей дошкольного и школьного возраста почка нормальных размеров не прощупывается. Если при пальпации живота удается определить почку – это указывает на ее увеличение или смещение (гидронефроз, подвижная почка и др.).
Характер стула у детей первого года жизни зависит от вида вскармливания. При грудном вскармливании кал золотисто-желтого цвета с кисловатым запахом; число испражнений у детей первого полугодия может доходить до 5, после 6 месяцев – 2–3 раза в день. При искусственном вскармливании кал светло-желтого цвета, имеет гнилостный запах; число испражнений в первом полугодии – 3–4 раза, во втором полугодии – 1–2 раза. Стул детей более старшего возраста всегда оформленный, темно-коричневый, не содержит патологических примесей, 1–2 раза в день.
Диарея – частое или однократное опорожнение кишечника с выделением жидких каловых масс. Острая диарея продолжается не более 2–3 недель, хроническая – более 3 недель.
Вода и электролиты в кишечнике всасываются и секретируются энтероцитами и колоноцитами. В эпителии ворсинок происходит всасывание ионов натрия, хлора, воды, в эпителии крипт – их секреция.
В патогенезе диареи участвуют четыре механизма: кишечная гиперсекреция, повышение осмотического давления в полости кишки, нарушение транзита кишечного содержимого, кишечная гиперэкссудация. При отдельных заболеваниях может преобладать тот или иной механизм.
Секреторная диарея развивается вследствие усиления секреции натрия и воды в просвет кишки, обусловленной воздействием бактериальных эндотоксинов (холера), энтеропатогенных вирусов, некоторых лекарств (лист сенны, кора крушины, ревень, касторовое масло). Она характеризуется безболезненной водяной диареей. При вирусных инфекциях стул жидкий, частый, без патологических примесей. Может быстро развиться обезвоживание организма.
Гиперосмолярная диарея развивается при повышенном поступлении в кишечник осмотически активных веществ (при синдроме нарушенного всасывания, приеме солевых слабительных, сорбита и др.). Среди синдромов мальабсорбции выделяют дисахаридную недостаточность (лактозную и сахарозную), целиакию (непереносимость глютена-глиадина), непереносимость белков коровьего молока. При этой форме диареи стул обильный, может содержать остатки полупереваренной пищи.
Гипер– и гипокинетическая диарея возникает в результате повышения моторной активности кишечника при неврогенной диарее, приеме слабительных, содержащих магний, и др. Стул жидкий или кашицеобразный, необильный, без патологических примесей.
Гиперэкссудативная диарея возникает вследствие «сброса» воды и электролитов в просвет кишки через поврежденную слизистую оболочку и сопровождается экссудацией белка. Наблюдается при воспалительных заболеваниях кишечника: сальмонеллезе (стул жидкий со слизью), дизентерии (стул частый, скудный, содержит слизь, гной, прожилки крови, дефекация сопровождается тенезмами) и др.
У детей раннего возраста при простой диспепсии наблюдается диспепсический стул: жидкий, с примесью зелени (из-за быстрого прохождения по кишечнику биливердина) и белых комочков (кальциевых мыл), кисловатого запаха. При гепатите стул ахоличный, серо-глинистого цвета, без патологических примесей.
Запор (задержка стула более чем на 48 часов) характеризуется скудностью и твердостью испражнений, может быть органического или функционального происхождения. Привычные запоры могут возникнуть у ребенка при неправильном приучении его к горшку (нарушается выработка рефлекса «проситься на горшок»), нарушении диеты (однообразное питание, отсутствие в рационе грубой клетчатки), систематическом употреблении слабительных средств и частых клизм. Органические запоры возникают при болезни Гиршпрунга и других аномалиях развития кишечника.
Рвота – сложный рефлекторный акт, обусловленный возбуждением рвотного центра, во время которого происходит непроизвольное выбрасывание содержимого желудка через рот. При различных инфекциях, интоксикациях, травмах черепа рвота появляется внезапно. При заболеваниях желудочно-кишечного тракта рвоте обычно предшествует тошнота.
У детей первого года жизни разновидностью рвоты являются срыгивания, которые возникают без напряжения брюшного пресса. Они могут наблюдаться у практически здоровых детей при перекорме, аэрофагии или быть симптомом начала заболевания (кишечной инфекции, ОРЗ и др.).
Боли в животе наблюдаются у детей довольно часто. Боль в животе у грудных детей может быть заподозрена на основании беспокойства, плача, импульсивных движений ногами («сучение» ножками).
Абдоминальная колика – приступ болей в животе от нескольких минут до часов возникает в результате спазма желудка, различных отделов кишечника при переедании, кормлении ребенка неадекватной по возрасту пищей, пищевой аллергии, дисбактериозе.
Кишечная инвагинация – остро возникающая сильная боль в животе, рвота, нарастают симптомы интоксикации. Живот напряжен.
Аппендицит – боли в животе, локализующиеся внизу живота справа. Дети младшего возраста не могут оценить локализацию боли и обычно указывают на боль вокруг пупка. Боль сильная, приступообразная либо постоянная, ноющая, затем присоединяются тошнота, рвота, повышение температуры. При пальпации живота наблюдаются напряжение мышц в правой подвздошной области, положительные симптомы Блюмберга – Щеткина и др.
Острый панкреатит – опоясывающие боли с преимущественной локализацией слева, выше пупка.
У детей старше 5 лет боли в животе могут наблюдаться при гастрите, язвенной болезни желудка и двенадцатиперстной кишки, холецистите и др. У девочек боли в животе могут возникнуть при кисте яичников, кровоизлияниях в них.
Кишечная инвагинация, аппендицит, ущемленная грыжа и другие заболевания могут быть причиной развития перитонита, при котором боль становится разлитой, усиливается при глубоком вдохе, кашле. Нарастают явления интоксикации.
Лабораторные методы исследования
Анализ крови
Кровь составляет 6–11 % общей массы тела, является внутренней средой организма, обеспечивающей нормальное функционирование всех органов и тканей. Физиологические функции крови следующие: дыхательная – перенос кислорода от легких к тканям и углекислоты от тканей к легким; питательная – транспорт питательных материалов от пищеварительного тракта к тканям; экскреторная – удаление продуктов обмена веществ от тканей к органам выделения (мочевина, креатинин и др.); терморегулирующая; поддержание водного баланса; защитная – в крови содержатся антитоксины, антитела, белые форменные элементы, участвующие в поглощении микробов и осуществляющие иммунную защиту; регулирующая – кровь является связующим звеном между нервной системой, гормонами, медиаторами.
Состав форменных элементов крови зависит от функции органов кроветворения, органов разрушения форменных элементов и состояния депонирующих систем.
В норме кровь сохраняет относительное постоянство количественного и качественного состава, но в то же время она является одним из наиболее чувствительных показателей изменений, происходящих в организме под влиянием различных физиологических состояний (мышечная работа, пищеварение и др.) и патологических процессов.
На протяжении периода детства наблюдаются значительные изменения морфологического состава крови (табл. 5, 6).
В крови новорожденного ребенка большое количество эритроцитов, гемоглобина, лейкоцитов. Имеются и качественные отличия крови новорожденных от крови детей более старшего возраста: выражены анизоцитоз, макроцитоз, большее количество ретикулоцитов (8–20 ‰).
Таблица 5
Нормальные показатели крови у детей (B. Levin, 1987, в модификации)

Таблица 6
Показатели биохимического исследования крови у детей 3–14 лет (М. С. Игнатова, Ю. Е. Вельтищев, 1982)

В течение первого года жизни количество эритроцитов и гемоглобина снижается, затем вновь возрастает (табл. 5). Количество лейкоцитов у детей грудного возраста колеблется от 9 · 109/л до 12 · 109/л, после года оно снижается до 6 · 109–9 · 109/л.
В лейкоцитарной формуле крови детей раннего возраста преобладают лимфоциты. У детей в возрасте от 1 месяца до 1 года количество лимфоцитов в среднем составляет 60 %, нейтрофилов – 27–30 %. После 1 года отмечается увеличение в крови нейтрофилов и уменьшение лимфоцитов, к 5–6 годам количество их сравнивается и составляет по 45 % (второй перекрест кривой нейтрофилов и лимфоцитов). После 6 лет количество нейтрофилов продолжает возрастать и к 9–11 годам составляет 60 %, а количество лимфоцитов снижается до 30 %. Количество эозинофилов у детей составляет 1–3 %, моноцитов – около 10 %, тромбоцитов – 200–300 · 109/л, СОЭ – 6–10 мм/ч. Число ретикулоцитов на первом году жизни в среднем 5–6 ‰, после года – 1–2 ‰.
Анализ мочи
Анализ мочи относится к абсолютно обязательным исследованиям, проводимым при диспансерном обследовании здоровых детей и детей с различными заболеваниями.
Мочеобразование является результатом процессов фильтрации, реабсорбции и секреции, происходящих в нефронах. Нефрон состоит из клубочка, окруженного капсулой (мальпигиево тело), и почечных канальцев.
Процесс фильтрации происходит через полупроницаемый клубочковый фильтр, в результате образуется первичная моча, которая по своему химическому составу является ультрафильтратом плазмы, не содержащим белок и клеточные элементы.
Объем фильтрации зависит от количества функционирующих клубочков, скорости гломерулярного кровотока, градиента гидростатического давления между кровью в капилляре клубочка и жидкостью в бауменовой капсуле.
В канальцах происходят процессы реабсорбции, секреции и синтеза веществ. Через стенку канальцев реабсорбируются вода, глюкоза, аминокислоты, витамин С, диффундируют мочевина, углекислота и некоторые другие вещества. Клетки канальцев обладают системами активного транспорта, обеспечивающими перенос веществ против градиента концентрации из просвета канальцев в кровь и из внеклеточной жидкости в мочу.
В клетках канальцев синтезируется ряд соединений, поступающих в кровь или мочу.
Регуляция процессов мочеобразования осуществляется нервным и гуморальным путем через гипофиз, надпочечники и др.
Дети грудного возраста выделяют относительно большее количество мочи, чем дети старшего возраста. Суточный диурез у детей 1 года – 400–450 мл, в 10 лет – 1100–1500 мл.
Цвет мочи в норме – желтый, интенсивность окраски зависит от концентрации мочевых пигментов. Длительное выделение бледной мочи характерно для несахарного и сахарного диабета, хронической почечной недостаточности. Примесь свежей крови окрашивает мочу в розово-красный цвет. Моча, содержащая билирубин, имеет желто-бурую окраску. Изменение окраски мочи наблюдается при приеме ряда лекарств (метиленовая синь, рибофлавин и др.) и употреблении продуктов, содержащих пигменты (свекла).
Свежевыпущенная моча прозрачна. Мутность мочи при отстаивании обусловлена солями. Выделение мутной мочи является признаком патологии и зависит от присутствия большого количества солей, клеточных элементов, бактерий, слизи, жира.
Моча обычно имеет слабокислую реакцию, но ее кислотность может колебаться в широких пределах (рН от 4,5 до 8,5) в зависимости от характера пищи и принимаемых лекарств.
Относительная плотность мочи пропорциональна концентрации в ней осмотически активных частиц и в основном характеризует реабсорбционную функцию канальцев. Снижение относительной плотности мочи – гипостенурия (1002–1005 г/л) – наблюдается при обильном питье, в период схождения отеков, при несахарном диабете и др.
Изостенурия – фиксированная относительная плотность мочи, равная плотности плазмы крови (1010–1012 г/л), появляется при тяжелой почечной недостаточности. Повышение относительной плотности мочи может быть при больших потерях жидкости (лихорадка, понос, рвота), сахарном диабете, нефрозе и др.
Элементы осадка мочи – органические (клеточные элементы, цилиндры) и неорганические (различные соли) – определяются при микроскопическом исследовании.
Органические элементы осадка:
1) клетки плоского эпителия в нормальной моче – 1–2 клетки в поле зрения; увеличение их количества свидетельствует о слущивании эпителиального покрова мочевыводящих путей (воспаление, гиповитаминоз А и др.);
2) клетки цилиндрического эпителия, единичные в препарате;
3) клетки почечного канальцевого эпителия; увеличение их количества наблюдается при нефротическом синдроме, хроническом гломерулонефрите;
4) эритроциты могут быть единичные (0–1 в поле зрения). Выделение эритроцитов с мочой – гематурия. Макрогематурия определяется по изменению цвета мочи. Микрогематурия – увеличение количества эритроцитов в моче до 100 в поле зрения, не отражается на цвете мочи. Гематурия – частый симптом заболеваний мочевыделительной системы, может также наблюдаться при различных нарушениях свертывания крови (ДВС-синдром, гемофилия, тромбоцитопения и др.);
5) в нормальной моче присутствуют единичные лейкоциты (0–2 в поле зрения у мальчиков, 5–6 – у девочек). Увеличение выделения лейкоцитов с мочой – лейкоцитурия. Массивная лейкоцитурия – пиурия – всегда является инфекционной и характерна для пиелонефрита. Умеренная лейкоцитурия (до 30–40 в поле зрения) может быть и асептической;
6) цилиндры – белковые (гиалиновые и восковидные) и содержащие в белковой основе различные включения (клетки, соли, жир);
7) бактериурия.
Химическое исследование мочи заключается в определении в ней содержания белка, сахара, желчных пигментов, ацетона и др.
Наряду с разовым исследованием мочи производят количественное определение эритроцитов, лейкоцитов, цилиндров либо в моче, собранной в течение суток (проба Каковского – Аддиса), либо собранной за 2 часа (проба Амбурже), либо в 1 мл мочи (проба Нечипоренко).
При пробе Каковского – Аддиса в норме количество эритроцитов до 1 000 000, лейкоцитов – до 2 000 000, цилиндров – до 10 000. При пробах Амбурже и Нечипоренко количество эритроцитов до 1000, лейкоцитов – 200, цилиндров – до 70.
Для оценки колебаний в течение суток количества выделенной мочи и ее относительной плотности используют пробу Зимницкого, которую проводят при обычном пищевом и водном режимах и обычной двигательной активности. Мочу собирают за трехчасовые периоды. Учитывают количество жидкости, которое получил ребенок (питье и пища). В норме суточный диурез составляет 2/3 от принятой жидкости, из них 2/3 – дневной диурез и 1/3 – ночной. Относительная плотность мочи колеблется в широких пределах: 1005–1025.
Проба Райзельмана аналогична пробе Зимницкого, но мочу собирают в те часы, когда у больного имеется естественная потребность диуреза.
Олигурия – уменьшение суточного количества мочи – наблюдается при лихорадке, обезвоживании, острой почечной недостаточности, в период образования отеков.
Анурия – диурез меньше 1/15 нормы или полностью отсутствует, всегда свидетельствует о почечной недостаточности.
Полиурия – увеличение диуреза в два и более раза по сравнению с нормой, может возникнуть при обильном питье, наблюдается при сахарном и несахарном диабете, в период схождения отеков и др.
Копрологические исследования
Анализ кала (испражнений) – содержимого дистального отдела толстого кишечника, выделяющегося при дефекации, – имеет большое значение для диагностики заболеваний желудочно-кишечного тракта. Копрологическое исследование включает в себя макроскопическое, микроскопическое, химическое и бактериологическое исследования.
Макроскопическое исследование. Консистенция каловых масс зависит главным образом от времени их пребывания в толстой кишке. Ускорение перистальтики ведет к недостаточному всасыванию воды и появлению жидкого стула, замедление – к избыточному всасыванию воды, кал становится плотным. Более жидкую консистенцию кал приобретает и при обильном выделении стенкой кишечника воспалительного экссудата и слизи.
Коричневый цвет кала обусловлен присутствием в нем продуктов превращения билирубина. Неизмененный билирубин придает калу золотисто-желтый цвет, который в норме наблюдается только у грудных детей. При непоступлении желчи в кишечник кал приобретает серо-белый цвет. Цвет кала меняется при значительных кровотечениях в желудочно-кишечном тракте. Темно-коричневый (дегтярный) кал – при кровотечениях из желудка. Чем ниже по ходу кишечника расположен очаг кровотечения, тем менее выражен дегтярный цвет. При кровотечениях из толстой кишки цвет кала красный (свежей крови).
Микроскопическое исследование кала дает возможность судить о степени переваривания компонентов пищи. Мышечные волокна присутствуют при ферментативной недостаточности желудка и поджелудочной железы, ускоренном транзите пищевого химуса, а также при употреблении ребенком мяса, недостаточно хорошо обработанного (плохо измельченного) или в большом количестве.
Крахмальные зерна в норме в кале отсутствуют, так как серия амилолитических ферментов приводит к полному расщеплению крахмала. Появляются они при недостаточной функции поджелудочной железы, заболеваниях тонкого кишечника.
Нейтральный жир и жирные кислоты почти или полностью отсутствуют в кале, если в пище содержалось умеренное количество жира. Остаток жира пищи обнаруживается в виде мыл. Содержание нейтрального жира в большом количестве свидетельствует о недостаточности липазы поджелудочной железы, а большое количество жирных кислот – о малом поступлении в кишечник желчи.
Переваримая клетчатка не должна присутствовать в кале, ее наличие свидетельствует об усиленной перистальтике толстой кишки. Непереваримая клетчатка представляет собой опорную ткань (оболочки злаков, плодов и др.), и ее присутствие в кале нормально.
Лейкоциты в норме в кале отсутствуют. Обнаружение лейкоцитов в слизи свидетельствует о наличии колита. При язвенных процессах в слизи находят и эритроциты.
При микроскопическом исследовании определяют также содержание в кале простейших (лямблии, амебы), глистов и их яиц.
Бактериологическое исследование кала должно производиться во всех случаях поносов. Посевы должны быть сделаны по возможности быстро из свежевыделенного кала, так как ряд патогенных микробов (возбудители дизентерии и др.) обладают слабой выживаемостью и в течение 2–3 часов могут погибнуть в кале.
Инструментальные методы обследования
Рентгенологические методы исследования
Рентгенологическое исследование грудной клетки обычно начинается с рентгенографии, при необходимости используется рентгеноскопия.
Рентгеновский снимок грудной клетки в прямой проекции непременно делают в вертикальном положении ребенка, исключение допустимо только для детей в очень тяжелом состоянии, в послеоперационном периоде.
На рентгеновском снимке в норме на фоне прозрачных легочных полей прослеживается легочный рисунок. В норме у детей в его образовании в большей степени участвуют артерии, в меньшей – вены и бронхи. Для нормального легочного рисунка характерны радиальность хода его элементов от корня к периферии, истончение его к периферии и исчезновение его элементов, не доходя до периферии легочных полей на 1–2 см.
При заболеваниях прозрачность легочных полей и легочный рисунок изменяются. Прозрачность легочных полей увеличивается при эмфиземе легких, значительно снижается при пневмониях. Сплошное равномерное затемнение в пределах целой доли – при долевых пневмониях, в пределах отдельных легочных сегментов – при сегментарных пневмониях, небольшие нерезкие участки затемнения на фоне эмфиземы – при очаговых пневмониях.
Усиление легочного рисунка в прикорневых зонах выявляется при бронхитах. При сердечной патологии, протекающей с объемной перегрузкой сосудов малого круга кровообращения, легочный рисунок усилен и прослеживается до периферии. При врожденных пороках сердца, протекающих с уменьшением кровотока в сосудах малого круга кровообращения, легочный рисунок обеднен, заканчивается в средней трети легочных полей. Наблюдается повышенная прозрачность легочных полей.
При пневмотороксе область, занятая газовым пузырем, имеет повышенную прозрачность, легочной рисунок отсутствует, поджатое легкое смещено в здоровую сторону.
Большое количество жидкости в плевральной полости резко понижает прозрачность легочного поля и оттесняет органы средостения в здоровую сторону.
Рентгенологическое исследование позволяет уточнить форму сердечной тени, размеры сердца, крупных сосудов. Для этого целесообразно сделать снимки в четырех проекциях – прямой, правой, левой косой и левой боковой (причем правую косую и левую боковую с контрастированием пищевода).
В передней прямой проекции сердечная тень в норме располагается асимметрично по отношению к срединной линии тела (1/3 сердечной тени находится справа от срединной линии, 2/3 – слева).
Изменение этих соотношений свидетельствует либо о смещении сердца в ту или другую сторону, либо о повороте его вправо в результате изолированной гипертрофии правого желудочка, либо об аномалии положения сердца.
Правый контур сердечной тени образован двумя дугами: первая – восходящая аорта и верхняя полая вена, вторая – правое предсердие. Между дугами находится атриовазальный угол, расположенный на уровне переднего отрезка IV ребра – III межреберья. Смещение атриовазального угла вверх и удлинение второй дуги – признак увеличения правого желудочка, который становится краеобразующим.
Левый контур имеет четыре дуги: первая – аорта (участок перехода дуги аорты в нисходящий отдел, так называемая «пуговка аорты»), вторая – легочной ствол, третья – ушко левого предсердия, четвертая – левый желудочек. Вторая и третья дуги формируют «талию» сердца, по силуэту которой различают три конфигурации сердца: 1) нормальную; 2) митральную («талия» сглажена или исчезает в результате выбухания второй или третьей дуги); 3) аортальную («талия» западает).
Первая (правая) косая проекция по переднему контуру имеет следующие дуги: первая – восходящая аорта, вторая – conus pulmonalis (место перехода правого желудочка в легочный ствол), третья – передняя стенка правого желудочка. Левый желудочек в норме не доходит до переднего контура, но там, где тень сердца отклоняется кзади, краеобразующей становится передняя стенка левого желудочка. В норме между грудной стенкой, диафрагмой и контуром левого желудочка имеется участок легочной ткани, исчезновение которого является признаком систолической перегрузки левого желудочка. Задний контур имеет также три дуги: первая – восходящая аорта, вторая – левое предсердие, третья – правое предсердие.
Контрастированный пищевод на уровне предсердий идет параллельно передней поверхности позвоночника. Отклонение его кзади является признаком увеличения левого предсердия.
Во второй (левой) косой проекции передний контур имеет три дуги: первая – восходящая аорта, вторая – правое предсердие, третья – правый желудочек. Задний контур образует следующие дуги: первая – дуга аорты, вторая – левое предсердие, третья – левый желудочек. В этой проекции видны все отделы сердца аорты – восходящая часть, дуга, нисходящая часть, образующие «аортальное окно».
В левой боковой проекции передний контур от диафрагмы вверх образован правым желудочком. Вершина угла, образованного правым желудочком и грудиной, находится на уровне наибольшего поперечного размера сердца. Смещение вершины угла вверх является признаком увеличения правого желудочка. Задний контур имеет две дуги: первая – левое предсердие, вторая – левый желудочек. Виден треугольник полой вены, образованный стенкой левого желудочка, пищеводом и диафрагмой. При увеличении левого желудочка край его приближается к пищеводу – происходит закрытие треугольника (рис. 2).

Рис. 2. Схематическое изображение тени сердца: I – передняя прямая проекция; II – правая косая проекция; III – левая косая проекция; IV – левая боковая проекция: А – аорта; ЛС – легочный ствол; ЛП – левое предсердие; ПП – правое предсердие; ЛЖ – левый желудочек; ПЖ – правый желудочек; Тр. – трахея; Лбр. – левый бронх
Для определения размеров сердца рассчитывается кардиоторокальный индекс – соотношение поперечных размеров сердца и грудной клетки. Кардиоторокальный индекс у детей до 1 года равен 55, после 1 года уменьшается до 50–45.
Рентгенологическое исследование также имеет большое значение для определения наличия выпота в полости перикарда.
Томография – метод послойной рентгенографии, при которой получаются изображения образований, залегающих на различной глубине грудной клетки. Только детали исследуемого (избранного) слоя имеют четкое контрастное изображение на томограмме, тогда как элементы слоев, расположенных поверхностнее или глубже, «размываются» и не видны. Толщина томографического слоя колеблется от 0,5 до 2 см и более, изображение по сравнению с рентгенографическим всегда больше по размерам и гомогеннее.
Компьютерная томография дает поперечное изображение любого участка человеческого тела по типу так называемого «пироговского среза».
Бронхография – рентгенография бронхов, просвет которых заполнен контрастным веществом, обычно производится под общим наркозом. Бронхографию проводят при наличии хронического бронхолегочного процесса, чтобы выяснить степень и распространенность поражения. Бронхографию всегда проводят в плановом порядке, в период, когда активность воспалительного процесса наименьшая.
Бронхография не показана при муковисцидозе и иммунодефицитных состояниях, так как полученные в результате исследования данные не повлияют на тактику лечения.
Электрокардиография
Электрокардиография – один из важных методов исследования сердца, дающий возможность уточнить характер аритмии, выявить наличие перегрузок камер сердца, гипертрофию желудочков, обменные нарушения в миокарде.
Электрокардиограмма (ЭКГ) – кривая записи биотоков сердца, состоящая из шести зубцов (P, Q, R, S, T, U), сегментов PQ, RST и интервалов P – Q, Q – T, T – P, R – R. Предсердный компонент состоит из зубца Р, в состав желудочкового компонента входят комплекс QRS, сегмент S – T и зубец Т (рис. 3).

Рис. 3. Схема зубцов и интервалов электрокардиограммы
Зубец Р отражает процесс возбуждения мускулатуры предсердий, имеет вид полуовала с закругленной верхушкой. Первая половина зубца Р до вершины соответствует возбуждению правого предсердия, вторая – от вершины до изолинии – левого предсердия. В норме во всех отведениях, за исключением avR, зубец Р положительный, в III стандартном отведении он может быть отрицательным, двухфазным или сглаженным. Ширина (продолжительность) зубца Р не превышает 0,09–0,10 с, высота – 3 мм.
Зубец Q – всегда отрицательный, отражает электродвижущую силу (ЭДС) межжелудочковой перегородки и частично верхушки правого желудочка.
Зубец R – всегда положительный, отражает ЭДС миокарда правого и левого желудочков.
Зубец S – непостоянный, всегда отрицательный, отражает ЭДС базальных отделов сердца.
Зубец Т – форма и амплитуда его в различных отведениях могут значительно колебаться, он отражает процесс реполяризации в желудочках.
Желудочковый комплекс QRS, отражающий распространение возбуждения в миокарде желудочков (деполяризация), имеет общую продолжительность 0,04–0,09 с.
Интервал P – Q соответствует времени прохождения импульсов от начала возбуждения предсердий до начала возбуждения желудочков, продолжительность его зависит от возраста, частоты сердечных сокращений и колеблется в пределах 0,11–0,18 с.
Интервал S – T (от конца зубца S до начала зубца Т) отражает период ранней реполяризации желудочков, продолжительность его 0,15 с. В норме сегмент S – T находится на изолинии, но возможно его небольшое смещение вверх (на 1 мм) и вниз (на 0,5 мм).
Интервал Q – T отражает электрическую систолу сердца, продолжительность его зависит от пола, возраста, частоты сердечных сокращений. Для определения должного интервала Q – T используют специальные формулы, таблицы, диаграммы.
Интервал T – P соответствует периоду отсутствия разности потенциалов на поверхности тела, когда все сердце находится в состоянии покоя.
Интервал R – R – продолжительность одного сердечного цикла. По времени интервала R – R можно определить частоту сердечных сокращений. Например, интервал R – R = 0,5 с, следовательно, за 1 минуту (60 с) будет 60: 0,5 = 120 сокращений сердца. По колебаниям интервала R – R судят о правильности ритма сердца: если колебания между отдельными интервалами превышают 10 % – говорят об аритмии.
У детей любого возраста ЭКГ записывается в трех стандартных отведениях, трех усиленных однополюсных отведениях от конечностей и в шести грудных отведениях.
Показатели ЭКГ принято измерять во II стандартном отведении с помощью линейки или по сетке, нанесенной на электрокардиографическую бумагу. Расстояние между горизонтальными линиями равно 1 мм, между вертикальными линиями – тоже 1 мм, при скорости движения ленты 50 мм/с оно соответствует 0,02 с.
ЭКГ детей разного возраста имеет некоторые различия, которые необходимо учитывать при ее анализе.
Фонокардиография
Фонокардиограмма (ФКГ) – графическая регистрация звуковых феноменов сердца (тонов, шумов), позволяющая объективно оценить их характеристику, локализацию.
Запись ФКГ производят в четырех классических точках: 1 – верхушка сердца, соответствует проекции митрального клапана; 2 – мезокардиальная (точка Боткина); 3 – проекция клапана легочной артерии; 4 – проекция клапана аорты.
Одновременно с ФКГ регистрируют ЭКГ, что позволяет произвести расчеты отдельных компонентов ФКГ.
ФКГ состоит из графической записи I и II тонов и интервалов между ними в виде изоакустической линии. Систола соответствует интервалу между I и II тоном, диастола – между II и I тоном. В интервале диастолы нередко регистрируются III и IV тоны.
I тон состоит из нескольких осцилляций, начальные осцилляции записывают через 0,03 с после зубца Q (R), продолжительность тона – 0,07–0,15 с.
II тон записывается в конце нисходящего колена зубца Т или вслед за зубцом Т, продолжительность его – 0,04–0,08 с. У детей часто регистрируется расщепление II тона: он состоит из двух компонентов – высокоамплитудного аортального и низкоамплитудного легочного, что обусловлено более ранним закрытием аортального клапана.
Функциональный систолический шум лучше регистрируется на средних частотах, занимая 1/2–2/3 систолы, небольшой амплитуды. Органические шумы хорошо регистрируются на высоких частотах (высокочастотные), могут занимать 1/2–2/3 или всю систолу (пансистолический). Диастолические шумы в зависимости от фазы диастолы, в которой они регистрируются, делятся на пресистолические, протодиастолические.
Ультразвуковое исследование (УЗИ)
Эхокардиография – локация органа импульсами ультразвуковых волн. Для записи ЭХО-сигналов используют ультразвуковой датчик – устройство, преобразующее электрическую энергию в механическую, и наоборот.
Процесс работы эхокардиографа можно представить следующим образом. Датчик посылает короткий ультразвуковой импульс, который линейно распространяется в гомогенной среде до тех пор, пока не дойдет до границы раздела сред (фаз), где и происходит отражение или преломление ультразвуковых лучей. Через определенное время отраженный звук (эхо) вернется к датчику, который теперь работает как приемник. Зная скорость распространения звуковой волны и время, за которое звук прошел расстояние от границы фаз и обратно, можно вычислить расстояние между датчиком и этой границей. Это соотношение между временем и расстоянием и лежит в основе звуковой визуализации органа.
Интенсивность принимаемого эхосигнала зависит от того, какая часть посланного сигнала отразилась от границы раздела фаз и вернулась к датчику. Интенсивность принятых эхосигналов может быть графически представлена на осциллоскопе (экране эхокардиографа) в различных режимах: А-модальным, В-модальным, М-модальным, режиме двухмерного изображения.
Для получения двухмерного изображения сердца в реальном времени производится сканирование (изменение направления ультразвукового луча) в секторе 60–90.
Доплер-эхокардиография. Эффект Доплера, на котором основано ультразвуковое исследование кровотока, состоит в том, что частота звука, издаваемого движущимся объектом, изменяется при восприятии этого звука неподвижным объектом. С помощью доплер-кардиографии можно определить скорость движения стенок сердца при их сокращении, скорость кровотока и др.
Цветное доплеровское сканирование заключается в наложении закодированных разными цветами (красным и синим) скорости, направления движения кровотока на двухмерное изображение сердца. Красный цвет соответствует кровотоку по направлению к датчику, синий – от датчика.
Эхокардиографическое исследование сердца позволяет определить объем предсердий, желудочков, толщину их стенок, оценить состояние межпредсердной и межжелудочковой перегородок, обнаружить патологические образования в полостях сердца (опухоли, тромбы), рассмотреть клапаны сердца, их строение, функционирование и др.
Доплеровская эхокардиография дает возможность оценить кровоток через каждый клапан, обнаружить внутрисердечные шунты и др.
Эхокардиографическое исследование позволяет обнаружить жидкость в полости перекарда.
УЗИ брюшной полости позволяет оценить размеры и структуру печени, селезенки, поджелудочной железы, почек, определить размеры, форму, расположение желчного пузыря, наличие в нем камней и др.
Оценка функции внешнего дыхания
Внешнее дыхание – обмен газов между внешним воздухом и кровью капилляров, осуществляется посредством простой диффузии газов через альвеолярно-капиллярную мембрану. Функции внешнего дыхания заключаются в артериализации крови в легких путем обогащения ее кислородом и выведении из организма избытка углекислого газа.
Для характеристики функции внешнего дыхания оценивают следующие показатели: легочную вентиляцию, легочные объемы, биомеханику дыхания, легочный газообмен, газовый состав крови, кислотно-осно́вное состояние (КОС).
Многие тесты, применяемые для исследования функции внешнего дыхания, могут быть проведены только у детей старше пяти лет, так как требуют активного участия обследуемого (проба с форсированным выдохом и др.).
Для того чтобы оценить результаты исследования внешнего дыхания, их сравнивают с величинами, рассчитанными по регрессивным уравнениям, отражающими связь дыхательных объемов с ростом детей и полом, или по номограммам.
Легочную вентиляцию оценивают по частоте, ритму, глубине, минутному объему дыхания, объему альвеолярной вентиляции и др.
Легочные объемы: общая емкость легких (ОЕЛ) – объем газа, содержащегося в легких после максимального вдоха; жизненная емкость легких (ЖЕЛ) – максимальный объем газа, выдыхаемого после максимального вдоха; остаточный объем легких (ООЛ) – объем газа, оставшегося в легких после максимального выдоха; функциональная остаточная емкость (ФОЕ) – объем газа, находящегося в легких после спокойного выдоха; резервный объем вдоха (РОвд) – максимальный объем газа, который можно вдохнуть от уровня спокойного вдоха; резервный объем выдоха (РОвыд) – максимальный объем газа, который можно выдохнуть после спокойного вдоха; емкость вдоха (ЕВ) – максимальный объем газа, который можно вдохнуть от уровня спокойного вдоха; дыхательный объем (ДО) – объем газа, вдыхаемого или выдыхаемого за один дыхательный цикл (рис. 4); форсированная жизненная емкость легких (ФЖЕЛ) – объем максимально быстро и полно выдохнутого воздуха после полного глубокого вдоха.

Рис. 4. Легочные объемы
ЖЕЛ, ФЖЕЛ, ЕВ, РОвд, РОвыд, ДО определяют с помощью спирографа; ОЕЛ, ФОЕ, ООЛ измеряют, применяя метод разведения гелия в закрытой системе.
Уменьшение ЖЕЛ более чем на 20 % от должной считается патологией и наблюдается при обструкции воздухоносных путей, пневмонии, пневмосклерозе и др.
Для оценки бронхиальной проходимости используется тест Тифно – отношение объема форсированного выдоха за 1 с (ОФВ1) ко всему объему форсированного выдоха (ЖЕЛ), выраженное в процентах: 75 % – нормальная величина, ниже 70 % – указывает на обструкцию дыхательных путей, выше 85 % – на наличие рестриктивных явлений.
Биомеханика дыхания – определение механических свойств дыхательного аппарата. Работу дыхания и характеристику аэродинамики определяют путем измерения внутригрудного давления, записи кривых давления – объем и др. К этой же группе показателей относятся и ФЖЕЛ, индекс Тифно, кривые поток – объем, дающие информацию о продвижении воздуха по дыхательным путям.
Для того чтобы обнаружить и измерить обструкцию дыхательных путей, определяют скорость пикового потока на выдохе при помощи минисчетчика пикового потока – пик-флоуметра. Обследуемый делает в аппарат максимально глубокий вдох, а затем короткий и резкий выдох. Полученный результат оценивают путем сравнения с данными номограмм (рис. 5).

Рис. 5. Номограмма пик-флоу и роста для детей
Семиотика отдельных патологических синдромов, их диагностика и лечение
Дыхательная недостаточность
Нарушение функции дыхания может наступить в результате нарушения внешнего дыхания, транспорта газов, тканевого дыхания.
Нарушение функции внешнего дыхания ведет к развитию гипоксемии, гипоксии, гиперкапнии, вследствие которых может развиться дыхательная недостаточность (ДН) – состояние, при котором функция внешнего дыхания не обеспечивает нормальный газовый состав артериальной крови. Клинически ДН проявляется одышкой, цианозом, степень выраженности которых определяет степень ДН.
При развитии ДН всегда имеет место гипоксия – патологический процесс, возникающий при недостаточном снабжении тканей кислородом.
Принято выделять четыре типа гипоксии в зависимости от вызывающих ее причин.
1. Гипоксическая гипоксия возникает по следующим причинам: снижение парциального давления кислорода, обусловленного снижением атмосферного давления (при подъеме на высоту); снижение парциального давления во вдыхаемом воздухе (при неисправности в системе кислородообеспечения кабин самолетов, подводных лодок и т. п.); нарушение функции внешнего дыхания в результате обструкции дыхательных путей (при крупе, инородных телах в дыхательных путях, скоплении мокроты, спазме бронхов и др.); нарушение регуляции дыхания (угнетение дыхательного центра); нарушение диффузии кислорода через альвеолярно-капиллярную мембрану (при пневмонии, отеке легких и др.); нарушение распределения воздуха в легких; избыточное шунтирование крови, когда часть крови, проходя через артериовенозные шунты, не достигает альвеол (при некоторых врожденных пороках сердца). Для гипоксической гипоксии характерны низкое напряжение кислорода в артериальной крови и малое насыщение крови кислородом.
2. Гемическая гипоксия возникает в результате уменьшения кислородной емкости крови при анемии и нарушении кислородсвязывающих свойств гемоглобина (при образовании метгемоглобина, карбоксигемоглобина). Для нее характерны сочетание нормального напряжения кислорода в артериальной крови с уменьшением содержания кислорода в артериальной и венозной крови и уменьшение напряжения кислорода в тканях.
3. Циркуляторная гипоксия может быть системной и органной. Системная застойная гипоксия возникает при недостаточности кровообращения, обусловлена нарушением венозного оттока и увеличением объема циркулирующей крови. Системная гипоксия развивается также при уменьшении систолического и минутного объемов кровообращения и возникает при кровопотере, обезвоживании, сердечной недостаточности. Ишемическая гипоксия – при местных нарушениях кровообращения.
Циркуляторная гипоксия может развиться при нарушении микроциркуляции в результате спазма артериол, замедления тока крови и наличия агрегации эритроцитов в различных отделах микроваскулярного русла (при пневмонии, токсикозах и др.) или в результате генерализованного вазоспазма (артериальные гипертензии различного генеза). Она также может развиться при уменьшении оксигенации артериальной крови (поступление венозной крови в артериальное русло при врожденных пороках сердца) и увеличении кислородного запроса тканей (при тиреотоксикозе, вследствие стимуляции обменных процессов).
При этой форме гипоксии напряжение кислорода в артериальной крови нормальное, но поступление кислорода в ткани уменьшено; напряжение и содержание кислорода в венозной крови снижены; большая артериовенозная разница по кислороду; гиперкапния.
4. Тканевая (гистотоксическая) гипоксия наступает вследствие нарушения способности тканей утилизировать кислород из крови в результате токсических воздействий, нарушающих функцию дыхательных ферментов (токсинами микробов, большими дозами некоторых лекарств, солями тяжелых металлов, воздействием ионизирующей радиации и др.). При этой форме гипоксии напряжение и содержание кислорода в артериальной крови нормальное, в венозной крови эти показатели повышены, артериовенозная разница по кислороду уменьшена.
При ДН в результате несоответствия между потребностью тканей в кислороде и его доставкой к ним происходит накопление в тканях большого количества органических кислот, развивается метаболический ацидоз. Из-за недостаточности окислительных процессов нарушаются обмен веществ, водно-электролитный баланс и др. Сдвиг рН крови в кислую среду вызывает смещение кривой диссоциации оксигемоглобина вправо, что приводит к снижению насыщения крови кислородом.
Для суждения о выраженности ДН предложен ряд ее классификаций. Классификация А. Г. Дембо: ДН I степени – одышка возникает при привычной физической нагрузке; ДН II степени – одышка при незначительной физической нагрузке; ДН III степени – выражена одышка в покое. Для детей раннего возраста используется классификация ДН, предложенная М. С. Масловым (табл. 7).
Для оценки степени ДН используются такие показатели, как парциальное напряжение дыхательных газов в крови и их содержание.
В артериальной крови в норме парциальное напряжение кислорода (РаО2) составляет 80–95 мм рт. ст., парциальное напряжение углекислого газа (РаСО2) – 40 мм рт. ст. По данным В. А. Михельсона и А. З. Маневича (1976), при ДН I степени РаО2 составляет 80–65 мм рт. ст., при ДН II степени РаО2 равно 65–51 мм рт. ст., при ДН III степени – ниже 51 мм рт. ст.
Таблица 7
Классификация степеней ДН у детей раннего возраста (по М. С. Маслову)

Общие принципы терапии ДН:
♦ аэротерапия, оксигенотерапия;
♦ поддержание проходимости дыхательных путей;
♦ улучшение гемодинамики, микроциркуляции, транспорта кислорода от легких к тканям;
♦ улучшение функции тканевого дыхания;
♦ ликвидация нарушений кислотно-основного равновесия.
1. Аэротерапия предусматривает хорошую аэрацию помещения, в котором находится больной.
При оксигенотерапии больному дают кислород, который может поступать через носовой катетер, закрепленный у входа в нос. При этом ребенок получает воздушную смесь, на 25 % обогащенную кислородом. Если кислород поступает через назофарингеальный катетер, введенный в нижний носовой ход так, что конец его находится на уровне язычка, тогда больной получает воздушную смесь, содержащую 30–35 % кислорода. Кислород нужно давать непрерывно в течение 2–5–10 часов, при показаниях вдыхание кислорода можно повторить.
Следует помнить, что кислород из баллона – абсолютно сухой газ, и использование его для дыхания допустимо только после хорошего увлажнения. Для этого струю кислорода нужно пропустить через столб воды высотой 10–15 см, предварительно раздробив ее на мелкие пузырьки, что достигается прохождением газа через мелкую сетку. Высокая влажность вдыхаемой смеси препятствует испарению влаги со слизистых оболочек дыхательных путей и уменьшает вязкость секрета.
При использовании кислородной палатки с хорошей герметизацией концентрация кислорода в ней достигает 60–70 %, при неполной герметизации – 25 %.
2. Для улучшения дренажной функции бронхов используют отхаркивающие средства (бромгексин, мукалтин, грудной эликсир, АЦЦ и др.), для снятия спазма бронхов – эуфиллин в/в 2,4 % раствор в разовой дозе детям до 1 года – 0,25–0,4 мл, до 3 лет – 0,5–1 мл, 4–7 лет – 1,5–3 мм, 8–14 лет – 3–5–7 мл. Эуфиллин можно назначить внутрь в разовой дозе детям до 2 лет – 0,01–0,03 г, до 6 лет – 0,03–0,05 г, до 12 лет – 0,05–0,15 г 2–4 раза в день (таблетки по 0,15 г).
Если обструкция ротоглотки вызвана слизью, скоплением мокроты, их можно удалить резиновой грушей или шприцем с надетым на него катетером. При неэффективности кашля для удаления мокроты используют постуральный дренаж с вибрационным массажем.
3. Улучшение гемодинамики достигается за счет применения сердечных гликозидов – строфантина или коргликона. Строфантин – 0,05 % детям до 1 года в разовой дозе 0,1–0,15 мл 1–2 раза в день в/в, медленно, в 10 % растворе глюкозы; после 1 года – в дозе 0,2–0,4 мл в зависимости от возраста. Коргликон 0,06 % вводится детям до 1 года в дозе 0,1–0,2 мл; после 1 года – в дозе 0,3–0,85 мл в зависимости от возраста, в 10 % растворе глюкозы в/в, медленно, 1–2 раза в сутки.
Для улучшения реологических свойств крови назначают трентал внутрь в зависимости от возраста по 1/4–1/2–1 таблетке 3 раза в день (таблетки по 0,1 г) или в/в детям до 1 года 0,5–1 мл, старше 1 года – 1–5 мл в 50 мл 10 % раствора глюкозы (1 амп. 5 мл содержит 100 мг препарата).
При развитии ДН на фоне анемии для восстановления кислородтранспортной функции крови необходимо активное ее лечение, вплоть до гемотрансфузий.
4. Улучшение функции тканевого дыхания достигается путем назначения комплекса витаминов С, В1, В2, В6, В15, Е, РР.
5. Для уменьшения метаболического ацидоза используют кокарбоксилазу в дозе 25–50 мг в/м или в/в 1–2 раза в сутки.
Если достигнуть и поддерживать нормальный газообмен с помощью консервативной терапии не удается, то больного переводят на искусственную вентиляцию легких (ИВЛ). Показаниями к переводу больного на ИВЛ являются клинические признаки (нарастают симптомы ДН) и данные анализа газов крови – снижение РаО2 ниже 60 мм рт. ст. и повышение РаСО2 выше 60 мм рт. ст.
Недостаточность кровообращения
Недостаточность кровообращения (НК) – состояние организма, при котором система кровообращения не обеспечивает полноценного кровоснабжения органов и тканей в соответствии с уровнем обмена. НК может возникнуть из-за нарушения сократительной функции миокарда и вследствие этого уменьшения сердечного выброса (сердечная недостаточность) и/или в результате изменения тонуса сосудов, перераспределения объема циркулирующей крови, нарушения микроциркуляции (сосудистая недостаточность).
Этиология. Брадикардии и брадаритмии приводят к синдрому малого сердечного выброса при частоте сердечных сокращений менее 65–70 % от возрастной нормы; развитие синдрома Морганьи – Адамса – Стокса; чрезмерная тахикардия (более 220–240 сердечных сокращений в 1 минуту для наджелудочных тахикардий и 120–140 сокращений в минуту для желудочковых тахикардий); острая слабость миокарда в результате токсического повреждения его (при гриппе, пневмонии, детских инфекционных заболеваниях и др.), воспаления (при миокардите), гемодинамической перегрузки (при пороках сердца и др.).
Среди причин, ведущих к развитию НК у детей раннего возраста, основными являются врожденные пороки сердца, у детей дошкольного и школьного возраста – миокардиты, эндокардиты, перикардиты. Нарушения сердечного ритма и кардиомиопатии могут быть причиной развития НК в любом возрасте.
В соответствии с причинами, приводящими к повреждению сердечной мышцы, выделяют следующие формы сердечной недостаточности.
1. Миокардиально-обменная форма наблюдается у больных миокардитом или при повреждении сердечной мышцы инфекционного, токсического или аллергического характера и обусловлена первичным нарушением обменных процессов в сердечной мышце.
2. Недостаточность сердца в результате его перегрузок. Перегрузка может быть обусловлена повышением сопротивления изгнанию крови из полостей сердца – перегрузка давлением и/или увеличением объема крови в сердечных камерах – перегрузка объемом. Снижение сократительной функции миокарда развивается на фоне гиперфункции и гипертрофии миокарда (при пороках сердца, артериальной гипертонии и др.).
Гипертрофия миокарда сопровождается повышением потребности его в кислороде и снижением эластических свойств мышцы сердца, из-за чего возникают нарушение обменных процессов и снижение напряжения миокарда во время систолы.
Патогенез. В основе сердечной недостаточности лежит энергонедостаточность миокарда, обусловленная прежде всего недостаточным снабжением миокарда кислородом.
Основным источником энергии, обеспечивающим сокращение сердечной мышцы, является расщепление АТФ, креатинфосфата и других макроэнергов, в которых аккумулируется энергия, получаемая за счет расщепления глюкозы. Во время диастолы АТФ и креатинофосфат ресинтезируются, причем если ресинтез осуществляется в присутствии достаточного количества кислорода (аэробным путем), то аккумулируется больше энергии, если при недостатке кислорода (анаэробным путем) – то значительно меньше.
При уменьшении энергообразования наступает нарушение ионного равновесия в миокардиальной клетке (снижается содержание калия, увеличивается содержание натрия и др.), ведущее к нарушению процессов возбуждения и сокращения миокарда.
Уменьшение количества кокарбоксилазы в сердечной мышце ведет к нарушению процесса декарбоксилирования пировиноградной кислоты и способствует развитию метаболического ацидоза.
Энергетическая недостаточность миокарда проявляется уменьшением систолического и минутного объемов кровообращения, увеличением остаточного диастолического объема крови, вызывающего повышение диастолического давления в полости сердца. Повышение давления в левом сердце ведет к нарушению кровообращения в сосудах малого круга кровообращения, альвеолярно-капиллярного газообмена и углубляет развитие гипоксии.
Повышение диастолического давления в правом желудочке вызывает повышение центрального венозного давления, застойные явления в сосудах большого круга кровообращения.
Снижение кровотока в сосудах почек ведет к уменьшению клубочковой фильтрации и сопровождается включением «почечного» звена в патогенез сердечной недостаточности: активацией ренин-ангиотензин-альдостероновой системы, приводящей к увеличению продукции антидиуретического гормона гипофиза, что приводит к задержке жидкости в тканях, увеличению объема циркулирующей крови, дилатации сердца и прогрессирующему снижению сердечного выброса.
В результате снижения силы сокращений сердца уменьшается скорость кровотока в артериях, увеличивается объем циркулирующей крови в микроциркуляторном русле и уменьшается скорость кровотока в нем, что способствует развитию агрегации эритроцитов и тромбоцитов, повышению вязкости крови, ведет к увеличению периферического сопротивления и еще большему увеличению рабочей нагрузки на сердце.
Гипоксия, возникающая при НК, способствует развитию патологических изменений в миокарде, мозге и паренхиматозных органах.
Клиника. НК может быть острой (развиться в течение часов или дней) и хронической.
Острая сердечная недостаточность может быть правожелудочковой, левожелудочковой или проявляться в виде общей энергодинамической недостаточности. Хроническая НК делится на три стадии: НК1, НК2а, НК2б, НК3.
Острая правожелудочковая недостаточность развивается в результате преимущественного снижения сократительной способности правого желудочка и сопровождается развитием застойных явлений, главным образом в большом круге кровообращения. Симптомы: бледно-цианотичный цвет кожи, цианоз носогубного треугольника, акроцианоз, одутловатое лицо, набухание шейных вен, пастозность или отечность ног и поясницы, одышка, кашель, тахикардия, тоны сердца приглушены или глухие, границы сердца расширены, увеличенная и болезненная печень. У маленьких детей одним из первых симптомов НК является нарушение акта сосания – дети плохо берут грудь, ведут себя у груди беспокойно или, наоборот, быстро засыпают.
Острая левожелудочковая недостаточность возникает в результате снижения сократительной деятельности левого желудочка при относительно хорошей сократительной способности правого. Развиваются легочная гипертензия, нарушение кровообращения в сосудах малого круга кровообращения, повышается проницаемость альвеолярно-капиллярных мембран, что ведет к развитию отека легких. Первые симптомы при развитии преимущественно левожелудочковой недостаточности весьма напоминают начало респираторного заболевания – появляются кашель, одышка, в легких на фоне жесткого дыхания выслушиваются влажные хрипы. При дальнейшем ее развитии появляются признаки сердечной аритмии и отека легких. Сердечная астма возникает в виде приступа удушья, тахикардии. Ребенок беспокойный, кожа бледно-цианотичная, покрыта холодным потом. Если приступ не купируется в течение ближайшего времени, то развивается отек легких. Состояние ребенка прогрессивно ухудшается, нарастают одышка, цианоз, дыхание шумное, клокочущее, кашель с выделением пенистой мокроты, пульс слабого наполнения, артериальное давление понижено, тоны сердца глухие, в легких выслушивается большое количество мелких влажных хрипов.
Энергодинамическая недостаточность сердца (синдром Хегглина II) – нарушения сократительной способности сердечной мышцы, которые развиваются в основном в результате сдвигов в электролитном обмене. Симптомы: бледность кожи, может быть умеренный цианоз, слабый пульс, выражена гипотензия, при тахикардии второй тон почти сливается с первым («стук дятла») в результате укорочения систолы, возможны обмороки. На ЭКГ – удлинение интервала Q – P. Застойные явления отсутствуют.
Для оценки выраженности гемодинамических нарушений при хронической недостаточности кровообращения используют классификацию, предложенную Н. Д. Стражеско и В. Х. Василенко (табл. 8).
Таблица 8
Классификация стадий недостаточности кровообращения (Н. Д. Стражеско, В. Х. Василенко)

Лечение. Комплексное, направленное на уменьшение нагрузки на сердце, включая постнагрузку, повышение сократимости миокарда, устранение гипоксии, ликвидацию расстройств, обусловленных нарушениями гемодинамики, и устранение причин, способствующих развитию НК.
Для лечения НК используют сердечные гликозиды, средства, улучшающие обменные процессы в сердечной мышце, влияющие на сосудистый тонус, состояние микроциркуляции, уменьшающие гипоксию мочегонные препараты.
Сердечные гликозиды, повышая сократимость миокарда, усиливают систолу желудочков и увеличивают продолжительность диастолы, замедляют проведение импульсов в синусовом узле, в атриовентрикулярном соединении. Под влиянием сердечных гликозидов у больных с НК увеличиваются систолический и минутный объемы кровообращения, уменьшается частота сердечных сокращений, центральное венозное давление, уменьшается количество циркулирующей крови, уменьшаются застойные явления в малом и большом кругах кровообращения.
Терапевтический эффект при использовании сердечных гликозидов наблюдается только при назначении полной терапевтической дозы препарата (дозы насыщения) с последующим применением поддерживающей дозы. Полная терапевтическая доза – такое весовое количество препарата, прием которого дает максимальный терапевтический эффект без появления симптомов интоксикации. Эта доза может быть введена в организм больного быстро – за 1–2 дня – или медленно – за 3–5 дней. Через 12 часов после последнего введения терапевтической дозы больной начинает получать поддерживающую дозу, равную коэффициенту элиминации (выведения), которая дается в два приема.
Для получения быстрого лечебного эффекта при развитии острой НК используют внутривенное введение строфантина или коргликона.
Если НК развилось у больного на фоне сердечной патологии – врожденного или приобретенного пороков сердца, кардиомиопатии и др., то целесообразно назначить дигоксин, который в острой ситуации надо ввести парентерально, а затем можно будет применять внутрь.
Средняя терапевтическая доза строфантина и коргликона для детей первых двух лет жизни 0,02 мг/кг/сут (0,04 мл/кг/сут 0,05 % раствора строфантина, 0,06 % раствора коргликона). Эту дозу необходимо разделить на 2 или 3 введения в течение суток.
Можно назначить 0,05 % раствор строфантина и 0,06 % раствор коргликона в следующих разовых дозах: детям до 1 года – 0,1–0,15 мл, 2–4 лет – 0,15–0,2 мл, 5–7 лет – 0,3–0,4 мл, 8–10 лет – 0,5 мл, старше 10 лет – 0,5–0,8 мл (Маркова И. В., Калиничева В. И., 1980). Ампулированный строфантин и коргликон необходимо развести в 10 % растворе глюкозы или изотоническом растворе натрия хлорида, вводить медленно, в течение 2–3 минут. Применять эти препараты целесообразно в течение 1–2–3 дней. При необходимости дальнейшего использования гликозидов больному можно назначить дигоксин внутрь в поддерживающей дозе.
Дигоксин назначают внутрь в полной терапевтической дозе 0,05–0,075 мг/кг, которую ребенок получает в течение 2–3 дней. Поддерживающая доза составляет 1/5 дозы насыщения. При назначении дигоксина внутривенно дозу уменьшают на 25 %. Выпускается дигоксин в таблетках по 0,25 мг и ампулах по 1 мл 0,025 % раствора.
Критериями терапевтического эффекта сердечных гликозидов служат улучшение общего состояния ребенка, урежение пульса до субнормальной или нормальной частоты, уменьшение или исчезновение одышки, уменьшение размеров печени, увеличение диуреза, исчезновение застойных явлений в легких.
Используя сердечные гликозиды, необходимо помнить о возможности интоксикации, так как даже идеально подобранная доза сердечных гликозидов при повышенной индивидуальной чувствительности больного к препарату может вызвать интоксикацию, которая также может развиться при гипокалиемии, одновременном назначении препаратов кальция.
Начальные симптомы интоксикации – вялость, потеря аппетита, тошнота, рвота, брадикардия, появление экстрасистол, на ЭКГ – удлинение интервала P – Q, снижение высоты зубца Т, изменение положения отрезка S – T. Затем увеличиваются размеры печени, уменьшается диурез.
При появлении симптомов интоксикации необходимо уменьшить дозу или отменить препарат, назначить лекарства, содержащие калий, комплекс витаминов С, В1, В6, В15, РР.
Абсолютным противопоказанием к назначению сердечных гликозидов является нарушение атриовентрикулярной проводимости II степени, относительным противопоказанием – атриовентрикулярная блокада I степени, выраженная брадикардия.
В лечении НК используют перисферические дилататоры – вещества, создающие более экономные условия для работы сердца. Они способствуют уменьшению диастолического давления, увеличению сердечного выброса, снижению давления в сосудах легких и др.
С учетом механизма действия периферические вазодилататоры делят на три группы:
1) лекарственные вещества, преимущественно расширяющие венозные сосуды, увеличивающие емкость венозной системы и уменьшающие венозный приток к сердцу (нитронг, эринит и др.);
2) лекарственные вещества, расширяющие преимущественно артериальные сосуды, снижающие периферическое сосудистое сопротивление, что улучшает условия выброса крови из левого желудочка (апрессин, фентоламин, пентамин);
3) препараты, оказывающие одновременное вено– и артериорасширяющее действие – ингибиторы ангиотензинпревращающего фермента (АПФ): каптоприл (капотен), эналаприл и др.
Выбор препарата определяется патофизиологическими особенностями НК у данного больного. Если в основе НК лежит уменьшение сердечного выброса, целесообразно использовать артериальные вазодилататоры. Их применяют при острой левожелудочковой недостаточности (сердечной астме, отеке легких). Пентамин назначают в дозе 2–3 мг/кг/сут детям до 3 лет и 1–1,5 мг/кг/сут детям более старшего возраста, в/м или в/в (ампулы по 1 мл 5 % раствора).
При развитии застойных явлений в легких можно использовать и венозные вазодилататоры.
Если необходимо повысить сердечный выброс и снизить легочно-сосудистое сопротивление, применяют ингибиторы АПФ, положительный эффект которых обусловлен блокадой вазоконстрикторных гормонов. В результате наступает дилатация артериол, венул, увеличивается диурез, повышается кровоток в работающих мышцах, умеренно повышается сердечный выброс, снижаются системное сосудистое сопротивление, давление в правом желудочке, а также легочное сосудистое сопротивление.
Каптоприл (капотен) назначают детям в начальной дозе 0,2–0,5 мг/кг/сут, дозу подбирают индивидуально, она может быть увеличена до максимума – 6 мг/кг/сут. Препарат применяют внутрь за 1 час до еды 2–3 раза в день, длительно (таблетки по 25 мг).
Эналаприл назначают в дозе 2–10 мг 2 раза в сутки детям старшего возраста.
При лечении НК полезно сочетание ингибиторов АПФ с сердечными гликозидами, при необходимости – с диуретиками.
В настоящее время в терапевтической литературе обсуждается вопрос об использовании селективных в1-адреноблокаторов (корвитола и др.) для лечения хронической НК. Препараты этой группы уменьшают потребность миокарда в кислороде, снижают активность ренина в плазме, обладают гипотензивным и антиаритмическим действием, уменьшают число сердечных сокращений, но снижают и сердечный выброс. В педиатрической практике они могут быть использованы в лечении хронической НК при дилатационной кардиомиопатии и ряде врожденных пороков сердца. При острой НК они противопоказаны.
Применяют также препараты калия. Панангин – препарат, в состав которого входят калий и магний, назначают по 1 драже 2–3 раза в день. Аспаркам назначают по 1/4–1/2–1 таблетке 3 раза в день в зависимости от возраста ребенка. Калинор (1 шипучая таблетка в готовом к употреблению растворе содержит 40,0 ммоль ионов калия, таблетку растворяют в 100–200 мл воды) назначают детям в зависимости от возраста по 1/4–1/2–1 таблетке в день. Все препараты калия с осторожностью назначают при олигурии, желательно под контролем ЭКГ.
При хронической НК в комплекс терапевтических средств для улучшения метаболических процессов в сердечной мышце целесообразно включить анаболические средства. Метандростенолон (неробол) назначают внутрь детям до 2 лет 0,1 мг/г/сут, от 2 до 5 лет – 1–2 мг/сут, 6–14 лет – 3–5 мг/сут в течение 2–3 недель (таблетки по 0,001 и 0,005 г).
Ретаболил назначают в дозе 5–7,5–10–15 мг в зависимости от возраста, в/м, однократно, 1 раз в 4 недели, при необходимости курс лечения через 3 месяца можно повторить.
Рибоксин положительно влияет на обменные процессы в миокарде, повышает сократительную функцию миокарда, улучшает коронарное кровообращение, оказывает антиаритмическое действие. Назначают внутрь до еды в дозе 0,2–0,6 г/сут в течение 3–6 недель (таблетки по 0,2 г).
Милдронат улучшает метаболические процессы в сердечной мышце. Назначают по 1 капсуле 1–3 раза в день (капсула 250 мг), курс лечения – 1–2 месяца.
Мочегонные средства назначают при выраженной недостаточности кровообращения. Имеется большой выбор мочегонных препаратов различного действия.
Гипотиазид повышает выделение из организма натрия, воды, меньше калия. Назначается детям в дозе 1–3 мг/кг/сут, дозу делят на 2–3 приема (таблетки по 25 и 100 мг). Препарат применяют 2–3 дня подряд, затем делают перерыв 3–5 дней.
Петлевые диуретики – фуросемид (лазикс) и этакриновая кислота (урегит) действуют на протяжении восходящего отдела петли Генле, резко угнетая реабсорбцию ионов хлора и натрия, значительно меньше – ионов калия. Диуретический эффект возрастает с увеличением дозы препарата и может быть получен даже при низкой клубочковой фильтрации. Фуросемид (лазикс) назначают внутрь, в/м, в/в в суточной дозе 1–3 мг/кг ежедневно, через день или 1–2 раза в неделю (таблетки по 40 мг, ампулы по 2 мл 1 % раствора). Этакриновая кислота (урегит) по сравнению с фуросемидом оказывает более сильное влияние на почечную гемодинамику, вызывает более интенсивное выведение хлора. Назначают в дозе 1–3 мг/кг/сут внутрь и в/в в виде прерывистого курса (2–3 раза в неделю).
Калийсберегающие диуретики – конкурентные антагонисты альдостерона (спиронолактоны) – тормозят выработку альдостерона корой надпочечников, в результате чего увеличивается выделение из организма натрия и воды. Верошпирон (альдактон) назначают внутрь детям школьного возраста в дозе 50– 200 мг/сут ежедневно, лучше в вечерние часы, в течение 2–3 недель (таблетки по 25 мг). Неконкурентные антагонисты альдостерона – триамтерен и амилорид. Их действие связано с уменьшением проницаемости клеточных мембран дистальных канальцев почек для ионов натрия и усиленного выделения их с мочой. Триамперен назначают внутрь в дозе 50– 150 мг/сут после еды, в 2–3 приема ежедневно, курсами по 7–8 дней (капсулы по 0,05 г). Амилорид назначают внутрь в дозе 5–20 мг/сут.
Триампур – комбинированный препарат, в одной таблетке которого содержится 25 мг триамтерена и 12,5 мг гипотиазида.
Для улучшения обменных процессов в миокарде применяют кокарбоксилазу в дозе 25–50–100 мг в/м или в/в, а также витамины С, В2, В6, В15, РР, Е.
Лечение отека легких. Для восстановления проходимости дыхательных путей производят отсасывание содержимого верхних дыхательных путей с помощью груши или электроотсоса. Для разгрузки малого круга кровообращения применяют диуретики – фуросемид (лазикс), сосудорасширяющие средства – пентамин. Из сердечных гликозидов используют строфантин или коргликон. Для снятия вторичного бронхоспазма и снижения легочной гипертензии можно применять эуфиллин в/в 2,4 % раствор: детям до 1 года – 0,1 мл/кг, старше 1 года – 2–6 мл в зависимости от возраста. Для уменьшения одышки, снятия беспокойства назначают седуксен 0,1–0,2 мл/год жизни, в/в (0,5 % раствор), пипольфен или дроперидол в дозе 0,25–0,5 мг/кг, в/в.
Назначают глюкокортикоиды, оказывающие сосудорасширяющее действие на легочные сосуды, бронхоспазмолитическое, антиаллергическое. Применяют преднизолон в разовой дозе 1–2 мг/кг, в/в или в/м 2–3 раза в сутки.
Для прекращения пенообразования используют вдыхание паров спирта. Детям младшего возраста дают дышать кислородом, пропущенным через 50 % этиловый спирт в течение 30–40 минут.
Последовательность проведения лечебных мероприятий при отеке легких может быть такая: применение седативных средств, пеногашение – ингаляция кислорода с этиловым спиртом, применение сосудорасширяющих препаратов, применение глюкокортикоидов, сердечных гликозидов, кокарбоксилазы и витаминов, применение мочегонных средств.
Диета при НК. Пища должна быть полноценной, содержать необходимое возрастным потребностям ребенка количество белков, жиров, углеводов и витаминов. В диету следует включать продукты, богатые калием (изюм, курагу, чернослив, картофель, творог и др.) и исключить продукты с избыточным содержанием соли.
Ограничить потребление жидкости необходимо при наличии отеков и олигурии. Показателем для определения количества жидкости является величина диуреза – ребенку дают столько жидкости, сколько он выделил мочи. Для грудных детей нельзя ограничивать количество пищи!
При выраженной НК число приемов пищи увеличивают до 4–5 раз в день, детей грудного возраста переводят на кормление сцеженным грудным молоком 6–8 раз в день.
Режим при НК строго индивидуален с учетом характера заболевания и выраженности явлений НК.
Острая почечная недостаточность
Острая почечная недостаточность (ОПН) – остро возникающее (в течение часов, дней) нарушение гомеостатических функций почек, приводящее к тяжелым обменным нарушениям – гиперкалиемии, гиперазотемии, гипергидратации, метаболическому ацидозу, анемии.
У детей ОПН развивается и протекает более бурно, чем у взрослых. Состояние потенциально обратимо, особенно при своевременном и правильном оказании неотложной медицинской помощи.
Причины развития ОПН разнообразны:
1) снижение почечного кровотока, развитие ишемии почек в результате кровопотери, обезвоживания (при рвоте, поносе и др.), острой недостаточности кровообращения, тяжелой аллергической реакции и др.;
2) первичное поражение почек (гломерулонефрит, пиелонефрит и др.);
3) токсическое повреждение почек под воздействием фосфорорганических соединений, лекарств, главным образом антибиотиков (аминогликозидов, тетрациклинов и др.), а также в результате трансфузионных осложнений;
4) нарушение оттока мочи вследствие закупорки мочевыводящих путей камнями или нарушения их целостности (при травме).
В течении ОПН выделяют четыре фазы: первая фаза – начальная; вторая фаза – олигурия; третья фаза – восстановление диуреза; четвертая фаза – выздоровление.
Клиника. В начальной фазе на фоне клинической картины заболевания, которое явилось причиной развития ОПН, отмечаются снижение диуреза, нарушение концентрационной способности почек – снижается плотность мочи до 1005–1008 г/л. Продолжительность фазы – от нескольких часов до 1–3 дней.
Фаза олигурии характеризуется резким снижением диуреза вплоть до анурии. Дети вялы, адинамичны. Отмечаются тошнота, рвота, боли в животе, явления энтероколита. Нарушается ритм дыхания. В результате гипергидратации появляются пастозность, могут развиться отек легких, отек мозга. В крови гиперазотемия, увеличено количество калия, магния, фосфора, натрия, снижено количество кальция, метаболический аценоз, анемия. Продолжительность фазы – от 2–3 дней до 2 недель.
В фазе восстановления диуреза выделяют период полиурии, для которого характерно значительное увеличение количества мочи при низкой ее плотности (1004–1919 г/л). Отмечаются слабость, головокружение. В крови снижено количество калия, натрия, хлора, сохраняется анемия. В первые дни полиурии азотемия держится и даже может нарастать, в последующие дни количество мочевины и креатинина в крови снижается до нормы. Продолжительность фазы колеблется от 4–6 дней до 3–4 недель, зависит от тяжести поражения почек.
В фазе выздоровления восстанавливается гомеостатическая функция почек. Длительность фазы – от 2–3 месяцев до 1–3 лет.
Лечение. Определяется фазой ОПН и заболеванием, на фоне которого развилась ОПН. В начальной фазе ОПН для профилактики ишемии почки и нормализации почечного кровотока используют осмодиуретики (маннитол), салуретики (фуросемид) и сосудорасширяющие средства. Маннитол в почках фильтруется, но не реабсорбируется, благодаря чему повышается скорость фильтрации мочи. Маннитол вводят в дозе 0,5 г/кг (лучше 10 % раствор) в/в в течение 2 часов. При отсутствии эффекта от его введения или если эффект слабо выражен, продолжение его инфузии противопоказано, так как это может вызвать гиперволемию.
Фуросемид вводят в дозе 2–3 мг/кг в/в однократно, медленно (максимальная суточная доза не должна превышать 80 мг).
Мочегонные препараты сочетают с сосудорасширяющими средствами – эуфиллином, допамином. В настоящее время предпочтение отдают допамину, который усиливает почечный кровоток и при сохраненной фильтрации – диурез. Препарат назначают в дозе 1–5 мкг (кг/мин). 200 мг препарата разводят в 400 мл 5 % раствора глюкозы или изотонического раствора хлорида натрия и вводят в/в со средней скоростью 1 мл/мин.
Для улучшения реологических свойств крови в/в вводят реополиглюкин в дозе 10 мл/кг.
Если применение указанных средств не привело к увеличению диуреза, то дальнейшая стимуляция диуреза бесполезна.
Во II фазе олигурии ОПН главными в лечении являются поддержание нормального водного баланса, коррекция гиперкалиемии, азотемии, ацидоза.
Объем жидкости, которую получит больной, можно рассчитать по формуле:
Суточный объем жидкости = 20 мл/кг + диурез + + потери с рвотой, поносом + 10 мл/кг на каждый градус повышения температуры тела выше 37 °C.
Назначается введение 10 % раствора глюкозы 200–400 мл + 4–8 ЕД простого инсулина (из расчета 1 ЕД инсулина на 5–6 г глюкозы) + 10–20 мл 10 % раствора глюконата кальция и 4 % раствора натрия гидрокарбоната в дозе 5–7 мл/кг/сут в/в капельно или струйно медленно.
Для удаления азотистых шлаков из организма производят повторные промывания желудка 2 % содовым раствором, количество жидкости для промывания у детей до 1 года – 100 мл на каждый месяц жизни, после года – 1,5–2–2,5 л и очистительные клизмы. Целесообразно назначить внутрь 50–100–200 мл 20 % раствора сорбита или полифепана.
Для подавления катаболизма белков назначают ретаболил 5–15 мг, в зависимости от возраста, в/м однократно.
Так как при анурии резко снижается сопротивляемость организма, для предупреждения развития инфекции назначают антибиотики пенициллинового ряда, большие дозы витамина С (200–300 мг), кокарбоксилазу.
После выведения ребенка из комы дают обильное питье, соки, свежие фрукты.
При быстром нарастании азотемии (повышение в крови мочевины до 24 ммоль/л), выраженной гиперкалиемии (критический уровень калия в плазме крови 6–7 ммоль/л) и выраженном ацидозе показан гемодиализ.
Клинические симптомы, являющиеся показанием к гемодиализу: 4–5-дневная анурия, неукротимые тошнота, рвота, угнетение сознания.
В период полиурии необходим тщательный контроль водно-электролитного баланса и восполнения потерь жидкости и электролитов.
Неотложные мероприятия, направленные на ликвидацию ОПН, сочетаются с лечением основного заболевания, приведшего к развитию ОПН.
Острая печеночная недостаточность
Острая печеночная недостаточность – клинический синдром, возникающий в результате тяжелого нарушения функции печени, при котором печень не в состоянии обеспечить потребности организма в обмене веществ, тканевой метаболизм, постоянство гомеостаза.
Функции печени многообразны. Печень является центральным органом обеспечения обменных процессов в организме и синтеза наиболее важных веществ. Именно поэтому она потребляет до 20 % кислорода, поступающего в организм. Печень принимает активное участие в углеводном обмене. В ней осуществляются синтез гликогена и его депонирование, обеспечивающее снабжение организма глюкозой. Участие печени в белковом обмене заключается в синтезе ряда белков – сывороточных, альбуминов, β-глобулинов, фибриногена. В ней также осуществляются все этапы катаболизма белков. В печени синтезируются основные плазменные факторы свертывания крови и противосвертывающей системы: протромбин, V–VII, VIII–XI факторы, гепарин, антитромбин и др. В ней также осуществляется синтез липидов (жирных кислот, нейтральных жиров, фосфолипидов, холестерина), глюкопротеидов. Печень участвует в водно-минеральном обмене, в обмене витамина D. В ней происходит утилизация железа гемоглобина, поступающего из разрушающихся в селезенке эритроцитов, его связь с ферритином – депонирование и обеспечение постоянного поступления в костный мозг.
Печень, наряду с почками и легкими, обеспечивает детоксикацию продуктов обмена. В ней происходит инактивация стероидных гормонов, альдостерона, гистамина, серотонина, катехоламина. Инактивации подвергаются метаболиты собственных аминокислот (фенол, аммиак и др.), а также чужеродные вещества (антибиотики, анальгетики и другие лекарственные препараты).
Печень – физиологическое депо крови. При острой кровопотере депонированная кровь поступает в кровоток, снижая дефицит объема циркулирующей крови (ОЦК).
Желчь является секреторным и экскреторным продуктом печени. С желчью выделяется билирубин, который образуется из гемоглобина при разрушении эритроцитов. Процесс преобразования гемоглобина до билирубина происходит в клетках ретикуло-эндотелиальной системы. Образовавшийся при этом свободный билирубин захватывается печеночными клетками (гепатоцитами), где, взаимодействуя с глюкуроновой кислотой, образует глюкуронид билирубина (связанный билирубин), который, поступая в кишечник, восстанавливается до стеркобилина и уробилина и выводится с мочой и калом.
Увеличение содержания в крови свободного билирубина свидетельствует о функциональной несостоятельности гепатоцитов, не способных синтезировать связанный билирубин, а повышение содержания в крови связанного билирубина является признаком холестаза.
Этиология. Заболевания печени – острый и хронический гепатит, цирроз печени, эхинококк; обтурация желчных протоков, приводящая к повышению давления в желчновыводящей системе, нарушению лимфо– и кровообращения в печени и развитию дистрофических изменений в гепатоцитах; инфекционные заболевания; заболевания сердца; отравления гепатоксическими веществами (ядовитые грибы, лекарственные препараты); экстремальные воздействия на организм (обширные ожоги, травмы, массивная кровопотеря и др.).
Какой бы ни была причина острой печеночной недостаточности, морфологические изменения печеночной ткани, гепатоцитов всегда однотипны. В основе дегенерации гепатоцитов всегда лежит гипоксия.
Нарушение белково-синтезирующей функции печени ведет к уменьшению коллоидно-осмотического давления плазмы крови, что в конечном счете способствует развитию интерстициального отека тканей, нарушению микроциркуляции, развитию гипоксии.
Снижение синтеза плазменных факторов свертывания крови способствует развитию геморрагического диатеза.
В результате нарушений углеводного обмена страдает энергетический баланс организма. Нарушение жирового обмена ведет к жировой дистрофии печени в результате отложения в ней нейтрального жира.
Клиника. Выделяют два основных синдрома острой печеночной недостаточности: синдром холестаза – развивается при нарушении желчевыделения и проявляется желтухой, обусловленной наличием в крови большого количества связанного билирубина; синдром печеночно-клеточной недостаточности возникает в результате дегенеративных изменений гепатоцитов и проявляется желтухой, обусловленной присутствием в крови свободного билирубина.
Степень выраженности морфологических и цитологических изменений гепатоцитов бывает различной, вплоть до некроза печеночной ткани, который может быть очаговым или распространенным, отсюда и различные клинические проявления и биохимические нарушения.
Некроз печеночной ткани всегда проявляется тяжелым состоянием больного, повышением температуры тела, увеличенной, болезненной печенью и увеличенной селезенкой, желтушной окраской кожи, склер, моча темного цвета, стул обесцвечен. Тахикардия. В начале развития острой печеночной недостаточности на коротком этапе наблюдается повышение артериального давления в результате распространенного сосудистого спазма, которое быстро сменяется гипотонией из-за вазодилатации и уменьшения объема циркулирующей крови, обусловленного переходом жидкой части крови в интерстициальное пространство при снижении коллоидноосмотического давления.
В процессе развития острой печеночной недостаточности ребенок очень возбужден, затем становится вялым, адинамичным, возникают разной степени нарушения сознания.
В клиническом анализе крови наблюдаются лейкопения, тромбоцитопения, СОЭ повышено.
При биохимическом исследовании крови выявляются гипербилирубинемия, гипопротеинемия, снижение содержания плазменных факторов свертывания крови. При обширных некрозах в крови появляются внутриклеточные ферменты – лактатдегидрогеназа, щелочная фосфотаза и др. В крови и лимфе – высокое содержание аммиака, метаболитов собственных аминокислот, оказывающих токсическое влияние на ткани.
Лечение. Кислородотерапия, которую проводят путем ингаляций кислорода (через кислородный ингалятор, носовой катетер, кислородную палатку), кроме того, гипербарическая оксигенация, питье кислородных коктейлей. Кислородотерапию необходимо сочетать с антиоксидантной защитой, чтобы предотвратить токсическое воздействие кислорода, так как при печеночной недостаточности содержание собственных антиоксидантов в организме больного значительно снижено.
В качестве антиоксидантов используют 5 % раствор унитиола в дозе 0,5 мл на 10 кг массы тела в сочетании с 5 % раствором аскорбиновой кислоты в дозе 0,3 мл на 10 кг массы тела в/в, β-токоферол 10 мг/кг в/м, солкосерил внутрь по 1 драже 2–3 раза в день (драже по 40 мг).
Назначают глюкокортикоидные гормоны – преднизолон 2–3 мг/кг, при необходимости дозу можно увеличить до получения положительного эффекта. Для улучшения микроциркуляции назначают трентал в/в 100–300 мг в зависимости от возраста ребенка (1 ампула 5 мл содержит 100 мг препарата) в 100 мл 10 % раствора глюкозы. Инфузионная терапия – введение 10 % раствора глюкозы из расчета 3–5 г сухого вещества на 1 кг массы тела.
Для улучшения ферментативных процессов назначают кокарбоксилазу 50–100 мг в/в или в/м, внутрь – эссенциале форте, глутаминовую кислоту, липоевую кислоту, витамины группы В, анаболические гормоны.
Кома диабетическая (диабетический кетоациноз)
Кома диабетическая кетонемическая – клинико-биохимический синдром, осложняющий течение сахарного диабета.
Сахарный диабет – заболевание, в основе которого лежит развитие хронической гипергликемии в результате снижения выработки инсулина поджелудочной железой, обусловленной генетическими и экзогенными факторами.
В классификации комитета экспертов ВОЗ (1999) выделены две основные патогенетические формы заболевания:
1) сахарный диабет I типа – он возникает в детском и юношеском возрасте, развивается быстро, течение болезни часто тяжелое, характерна склонность к развитию кетоацидоза, в подавляющем большинстве случаев необходима постоянная инсулинотерапия;
2) сахарный диабет II типа – возникает, как правило, у людей старше 40 лет, начало болезни медленное, течение легкое или среднетяжелое, без развития кетоацидоза.
Диабетическая кетонемическая кома осложняет течение сахарного диабета I типа, и у 1/3 детей сахарный диабет впервые диагностируется при развитии диабетического кетоацидоза.
Возникновение диабетического кетоацидоза у детей с диагностированным сахарным диабетом может быть обусловлено неадекватным введением инсулина (неправильный расчет дозы, прекращение введения инсулина) или увеличением потребности в инсулине (присоединение острых воспалительных заболеваний, при травме, стрессе, приеме глюкокортикоидов и т. п.). Тяжелый кетоацидоз может развиться при этом за 1–2 суток.
Ведущие факторы в патогенезе диабетического кетоацидоза – недостаточность инсулина, повышение продукции контринсулярных факторов (глюкагона, катехоламинов, кортизола, гормона роста), которые ингибируют глюконеогенез глюкозы в клетку, увеличивают глюконеогенез и липолиз из аминокислот и свободных жирных кислот. Избыток их превращается в печени в кетоновые тела. При диабетическом кетоацидозе развиваются глубокие нарушения обмена веществ, проявляющиеся гипергликемией, метаболическим ацидозом, дегидратацией, электролитными расстройствами. Характерно прогрессирующее нарастание метаболических нарушений.
В течение диабетического кетоацидоза различают три стадии: первая стадия – компенсированный кетоацидоз (кетоз); вторая стадия – декомпенсированный кетоацидоз (прекома); третья стадия – диабетическая кетонемическая кома.
На первой стадии гипергликемия сопровождается повышением осмотического давления в сосудистом русле, и для сохранения изоосмолярности происходит перемещение жидкости в сосуды с развитием осмотического диуреза, возникают клеточная дегидратация и дефицит внутри клеток ионов натрия, калия, хлора. Объем циркулирующей крови и уровень калия, натрия, хлора в плазме могут быть нормальными или умеренно повышенными. Повышение продукции кетоновых тел и развитие метаболического ацидоза компенсируются увеличением утилизации кетоновых тел в мышечной ткани, повышением их экскреции с мочой и через слизистую оболочку желудочно-кишечного тракта, нейтрализацией их буферными системами.
На второй стадии дегидратация также преимущественно внеклеточная. Во внеклеточном пространстве осмолярность повышается, начинается потеря экстрацеллюлярной жидкости, а также натрия и хлора из внеклеточного пространства. В результате истощения запасов гидрокарбоната повышается напряжение углекислого газа в крови, стимулирующее дыхательный центр, появляется одышка.
Для третьей стадии характерны общая дегидратация с уменьшением объема циркулирующей крови, потеря внеклеточного калия, декомпрессированный кетоацидоз. Содержание кетоновых тел значительно повышено. Уровень глюкозы в крови выше 20 ммоль/л и прогрессивно повышается. Глюкозурия, ацетонурия (++++), pH крови снижен (7,1–7,0).
Клиника. Первая стадия компенсированного ацидоза чаще развивается медленно – в течение нескольких дней, но у детей раннего возраста и на фоне стрессовых ситуаций (интеркурентные заболевания, травмы, эмоциональное напряжение и т. п.) может развиться в течение часов.
Основные симптомы сахарного диабета – полиурия, полидипсия, уменьшение массы тела. При развитии кетоацидоза все эти симптомы нарастают.
Развитие сахарного диабета у детей грудного возраста можно заподозрить при «беспричинной» потере веса ребенка, дети жадно и много пьют, часто мочатся. Пеленка, смоченная мочой, после высыхания становится как бы накрахмаленной, на ней можно обнаружить кристаллы сахара. Кожа и слизистые оболочки сухие, большой родничок западает. При развитии кетоацидоза резко нарушается аппетит, появляются срыгивания, рвота, увеличивается жажда.
Дети дошкольного и школьного возраста жалуются на слабость, недомогание, головную боль, жажду, частое мочеиспускание. Ребенок начинает вставать пить ночью, нередко появляется ночное недержание мочи. Кожа и слизистые оболочки сухие, тургор тканей снижен. Появляются тошнота, боли в животе, рвота, запоры, снижается аппетит, нарастает слабость, присоединяется сонливость. Уровень глюкозы в крови повышен до 11 ммоль/л и выше. Определяются полиурия, глюкозурия, кетонурия (+++), pH крови не ниже 7,3.
Вторая стадия характеризуется быстрым ухудшением состояния и нарастанием всех симптомов. Ребенок обезвожен, кожа сухая, холодная, тургор тканей резко снижен. Дыхание глубокое, редкое, шумное (типа Куссмауля) или частое, поверхностное. В выдыхаемом воздухе – запах ацетона. Губы сухие, язык сухой, с грязно-коричневым налетом. Тахикардия, артериальное давление понижено. Анорексия. Рвота возможна неукротимая, нередко цвета кофейной гущи. Схваткообразные боли в животе. Сознание сохранено, но больной заторможен, сонлив, на вопросы отвечает односложно, неохотно. Полиурия, глюкозурия, кетонурия.
Третья стадия – кома. Ребенок без сознания. Черты лица заострены. Мягкие глазные яблоки. Температура тела снижена. Выражена сухость кожи и слизистых оболочек, акроцианоз. Одышка, в выдыхаемом воздухе резкий запах ацетона. Тахикардия, тоны сердца глухие. Олигурия. В крови гипергликемия более 16–20 ммоль/л. Кетоноурия ++++, удельная плотность мочи высокая.
Диагноз диабетической кетонемической комы устанавливают на основании данных анемнеза и основных клинических симптомов: бессознательное состояние, выражены явления дегидратации организма, гипергликемия, кетоацидоз, олигурия, глюкозурия и кетонурия, развитие недостаточности кровообращения гиповолемического типа.
Дифференциальный диагноз диабетической кетонемической комы проводится с гипогликемией, гиперосмолярной диабетической комой, лактатацидозом и с заболеваниями, сопровождающимися нарушением сознания.
Неотложная помощь при диабетическом кетоацидозе включает в себя регидратацию, устранение дефицита инсулина, кетоацидоза, водно-электролитных расстройств.
Детей с первой стадией диабетического кетоацидоза можно госпитализировать в соматическое отделение, детей со второй или третьей стадией необходимо срочно госпитализировать в отделение реанимации.
Регидратация при невыраженном эксикозе, отсутствии рвоты может проводиться назначением жидкости через рот в виде соков, подслащенного чая, слабощелочной минеральной воды (боржоми, славяновской и т. п.).
При развитии прекомы и комы проводят инфузионную терапию, которую начинают с внутривенного введения 0,9 % раствора хлорида натрия. Ориентировочно в первые 6–8 часов вводят 20–30 мл/кг, в последующие 18 часов – 20–50 мл/кг, в зависимости от выраженности эксикоза. При гликемии ниже 10 ммоль/л переходят на введение 10 % раствора глюкозы. Инфузионная терапия продолжается в течение 16–24 часов до улучшения состояния, прекращения рвоты, ликвидации кетоацидоза. Введение растворов калия начинают обычно со 2-го часа терапии инсулином, так как с началом регидратации и инсулинотерапии концентрация К+ в плазме падает, и некомпенсированная гипокалиемия на фоне проведения регидратации может способствовать развитию отека мозга и нарушений сердечного ритма. Вводят раствор хлористого калия, скорость введения калия хлорида зависит от концентрации К+ в плазме. Уровень калия в крови желательно поддерживать в пределах 4–5 ммоль/л.
Инсулинотерапию начинают в стационаре только после лабораторного подтверждения гипергликемии и проводят под контролем гликемии. Инсулинотерапию проводят только препаратами короткодействующих инсулинов – astrapid, суинсулин и др.
При первой стадии кетоацидоза среднюю суточную дозу инсулина 0,7 ЕД/кг делят на 4–5 подкожных инъекций или вводят каждые 4 часа. Перед каждым введением инсулина следует определить уровень глюкозы в крови, в моче, кетоз в моче.
При второй или третьей стадии диабетического кетоацидоза необходимо внутривенное капельное введение инсулина в средней дозе 0,05–0,1 ЕД/кг/ч, при этом снижение содержания глюкозы в крови должно быть 4–5 ммоль/л/ч. При отсутствии снижения уровня гликемии в первые 2 часа от начала инсулинотерапии дозу инсулина увеличивают до 0,2 ЕД/кг/ч.
Продолжительность внутривенного капельного введения инсулина при второй стадии диабетического кетоацидоза – 18 часов, при коме – 24 часа.
Для улучшения микроциркуляции вводят гепарин в суточной дозе 200–400 ЕД/кг внутривенно капельно, каждые 6 часов, под контролем исследования свертываемости крови по Ли – Уайту.
Для профилактики инфекционных осложнений назначают антибиотики (полусинтетические пенициллины, цефалоспорины).
С началом инфузионной терапии больным вводят аскорбиновую кислоту 200–300 мг, кокарбоксилазу 50–100 мг в/в, струйно (в отдельных шприцах).
Больным с первой и второй стадиями диабетического кетоацидоза до начала инфузионной терапии, а с третьей стадией – после улучшения состояния делают очистительную клизму, по показаниям – промывание желудка.
После выведения из коматозного состояния и купирования кетоацидоза больного переводят на подкожное введение инсулина.
Гипогликемические состояния
Гипогликемическое состояние возникает в результате резкого снижения уровня сахара в крови. Оно может развиться у больных сахарным диабетом при инсулинотерапии или в результате передозировки инсулина, нарушения ритма приема пищи или при приеме сахароснижающих средств, при избыточной продукции организмом инсулина (инсуломе), дефиците контринсулярных факторов (болезнь Аддисона), заболеваниях печени, голодании, тяжелой физической нагрузке.
Глюкоза – основной источник энергии тканей мозга. При гипогликемии нарушается снабжение глюкозой головного мозга, происходит нарушение функции симпатико-адреналовой системы, поэтому в основе клинических проявлений гипогликемических состояний лежит дисфункция центральной нервной системы.
Клиника. Гипогликемическое состояние развивается быстро. На стадии предвестников ребенок испытывает внезапно развившееся ощущение слабости, тревоги, чувство сильного голода, появляются холодный пот, дрожание рук и ног, тахикардия. Если не принять срочных мер, то наступают сонливость, головная боль, судороги, потеря сознания.
Симптомы гипогликемических состояний появляются при уровне гликемии менее 3 ммоль/л.
Неотложная терапия. В период предвестников необходимо дать ребенку 2–3 кусочка сахара, конфету, сладкий чай. При развитии гипогликемической комы ввести внутривенно 10 % раствор глюкозы 20–50–100 мл. При судорогах – противосудорожная терапия – оксибутират натрия 50–100 мг/кг внутримышечно или внутривенно. После восстановления сознания ребенка следует накормить продуктами с высоким содержанием углеводов (булка и др.).
Лихорадка
Лихорадка – типовой патологический процесс, развившийся в процессе эволюции, характеризующийся изменением соотношений теплопродукции и теплоотдачи в сторону преобладания первой, проявляющийся в повышении температуры тела.
Лихорадка возникает при многих заболеваниях, в основном при инфекционных, и является неспецифической защитной реакцией организма. При лихорадке усиливаются фагоцитоз, выработка антител, образование интерферона, резко снижается репродукция вирусов, нарушается размножение бактерий. Исходы инфекционных заболеваний, сопровождающихся лихорадкой, лучше, чем протекающих без повышения температуры тела или при ее искусственном фармакологическом снижении. В то же время при развитии тяжелой гипертермической реакции (повышение температуры тела до 39–40 °C и выше) лихорадка теряет свои защитные свойства и вызывает тяжелые нарушения функций организма ребенка: нарушаются обмен веществ, деятельность ЦНС, сердечно-сосудистой и других систем, создаются предпосылки для нарушения свертывания крови и развития ДВС-синдрома, отека головного мозга.
В зависимости от исходного состояния организма (имеет значение наличие энцефалопатии, дистрофии, рахита, дыхательной, сердечно-сосудистой недостаточности и др.) переход лихорадки в гипертермическое состояние может произойти и при умеренном повышении температуры тела (38–38,5 °C). Нормальная температура тела ребенка 36–37 °C. Суточные колебания температуры тела у здоровых детей составляют 0,6–1,0 °C, максимальная температура наблюдается между 17 и 20 часами, минимальная – от 4 до 7 часов утра.
Лихорадка оценивается по высоте подъема температуры: субфебрильная – до 38 °C; фебрильная – от 38,1 до 41 °C, гиперпиретическая – выше 41 °C. В зависимости от длительности различают лихорадку эфемерную – от нескольких часов до 2 дней, острую – до 15 дней и хроническую.
При длительной лихорадке выделяют температурные кривые следующих типов:
♦ постоянная (jebris continua) фебрильная температура с суточными колебаниями менее 1 °C;
♦ послабляющая (jebris remittens) – с суточными колебаниями более 1 °C;
♦ перемежающаяся (jebris intermittens) – в течение суток повышение температуры сменяется спуском ее до субнормальных и нормальных цифр;
♦ гектическая (jebris hectica) – при ней суточные колебания температуры составляют 4–5 °C;
♦ неправильная (athypica) – колебания температуры не имеют определенной закономерности.
Лихорадочная реакция в своем развитии проходит три стадии: подъем температуры, стояние на высоком уровне и спад.
На первой стадии при быстром подъеме температуры резкий спазм кожных сосудов вызывает ощущение холода – озноб, появление «гусиной кожи», прекращение потоотделения. Эти явления свидетельствуют об ограничении теплоотдачи, одновременно возрастает теплообразование. В зависимости от нарушения кровообращения различают два варианта лихорадки у детей: «розовую» и «бледную». При варианте «бледной» лихорадки в результате сужения кожных сосудов и ограничения кровообращения на периферии при высокой температуре тела у ребенка холодные руки и ноги, кожа бледная; при варианте «розовой» лихорадки – кожные покровы теплые, розовые.
На второй стадии теплоотдача относительно возрастает и уравновешивается с теплообразованием. Кожное кровообращение становится интенсивнее. Чувство холода и озноб проходят, бледность кожных покровов может исчезнуть.
На третьей стадии (спада температуры) преобладает теплоотдача над теплопродукцией. Возникает потоотделение. Резкое расширение кожных сосудов при быстром снижении температуры тела может привести к развитию острой сердечно-сосудистой недостаточности.
Лечение. При выборе терапевтической тактики необходимо учитывать степень, длительность и клинические проявления лихорадки, возраст ребенка, преморбидный фон и причину, вызвавшую лихорадку.
Жаропонижающая терапия показана во всех случаях «бледной» лихорадки; при высокой лихорадке (39 °C и выше) и умеренной лихорадке (38 °C) у детей раннего возраста и детей, имеющих неблагоприятный преморидный фон (судорожный синдром, фебрильные судороги в анемнезе, перинатальная энцефалопатия и ее последствия и другие факторы риска).
При «розовой» лихорадке обычно внутрь или ректально в виде свечей назначают парацетамол детям до 1 года – 0,025–0,05 г, после 1 года – 0,1–0,25 г 2–3 раза в сутки (таблетки по 200 и 500 мг, сироп 2,4 % – 5 мл сиропа содержат 0,12 г; суппозитории 250 мг); эффералган с витамином С (таблетки содержат 330 мг парацетамола, 200 мг аскорбиновой кислоты) по 1/4–1/2–1 таблетке 1–2 раза в день; аспирин детям до 1 года – 0,025–0,05 г, старше года – 0,05–0,1–0,25 г на прием 4 раза в сутки.
Для того чтобы снять спазм периферических сосудов и увеличить теплоотдачу, центральные антипиретики можно сочетать с антигистаминными препаратами – пипольфеном или супрастином, внутрь в разовой дозе детям до 1 года – по 1/4 таблетки, от 1 года до 6 лет – по 1/3 таблетки, от 7 до 14 лет – по 1/2–1 таблетке 2–3 раза в день (таблетки по 25 мг).
При «бледной» лихорадке целесообразно использовать центральные антипиретики парентерально – в/м или в/в в сочетании с антигистаминными и спазмолитическими средствами. Назначают 50 % раствор анальгина в дозе 0,1 мл/год жизни в/м или раствор аспизола в разовой дозе 10 мг/кг (что соответствует 0,1 мл/кг готового раствора для инъекций) в/в или в/м в сочетании с 2,5 % раствором пипольфена в дозе 0,1 мл/год жизни в/м (можно использовать также тавегил или супрастин) или с 1 % раствором никотиновой кислоты в дозе 0,05 мл/кг.
При положительном терапевтическом эффекте от примененной терапии наблюдаются снижение температуры тела не менее чем на 0,5 °C в течение 30 минут и переход «бледной» лихорадки в «розовую».
Физические методы охлаждения используют только после применения лекарственных препаратов, уменьшающих спазм сосудов кожи и воздействующих на центры терморегуляции.
Круп
Круп – острое воспаление гортани (ларингит) или гортани, трахеи и бронхов (ляринготрахеобронхит), сопровождающееся явлениями стеноза гортани. В большинстве случаев круп имеет инфекционное происхождение. Причиной его чаще всего бывает вирус парагриппа 1. Он может также развиться при гриппе, кори и других инфекционных болезнях. В основе заболевания лежат воспаление и отек слизистой оболочки гортани. Болеют преимущественно дети 6 месяцев–3 лет.
Клиника. Для крупа характерна триада симптомов: 1) осиплость голоса вплоть до афонии; 2) грубый, лающий кашель; 3) стенотическое дыхание с усилением и удлинением вдоха.
Обычно круп развивается внезапно, чаще – среди ночи. Ребенок просыпается, становится беспокойным, появляются кашель, шумное, слышное на расстоянии дыхание.
В зависимости от выраженности стеноза гортани выделяют четыре ее стадии.
Первая стадия – компенсированная. Охриплость голоса, иногда прогрессирующая, вплоть до афонии, лающий кашель, при нагрузке – шумное дыхание с небольшим втяжением яремной ямки, лихорадка. Продолжительность стадии – от нескольких часов до суток.
Вторая стадия. Ребенок беспокоен, мучительный кашель, дыхание шумное с участием вспомогательной мускулатуры и западение при вдохе в области над– и подключичной ямок, межреберных промежутков. Тахикардия.
Третья стадия. Ребенок очень возбужден, кожа бледно-цианотичная, покрыта холодным, липким потом, цианоз губ, дыхание стенотическое, с резким втягиванием всех податливых мест грудной клетки. Одышка, тахикардия, тоны сердца глухие, в легких дыхание ослаблено.
Четвертая стадия – асфикция. Ребенок без сознания. Выражен цианоз кожи, губ. Дыхание поверхностное, периодически апноэ. Аритмия. Тоны сердца глухие.
Круп необходимо дифференцировать с инородными телами гортани, заглоточным абсцессом, дифтерией (дифтерийным крупом).
Лечение. На первой стадии показаны паровые ингаляции 3–4 раза в день, теплое частое питье (молоко, молоко с боржоми, содой), горячие ножные и ручные ванны (температура воды 38–39 °C). Антигистаминные препараты внутрь в разовых дозах: пипольфен и супрастин детям до 3 лет – 0,05–0,07 г, 4–10 лет – 0,008–0,01 г, 11–14 лет – 0,015–0,02 г 3 раза в день. Тавегил детям до 2 лет – по 1/4 таблетки, 2–6 лет – по 1/2 таблетки, старше 6 лет – по 1 таблетке 2 раза в день (таблетки по 0,001 г). Фенкарол детям до 3 лет – 0,003–0,005 г, 3–7 лет – 0,005–0,01 г, 8–14 лет – 0,015–0,025 г 3 раза в день (таблетки по 0,025 г). Отхаркивающие средства (грудной эликсир, мукалтин и др.), успокаивающие (настойка валерианы). Помещение, где находится ребенок, должно быть хорошо проветрено и иметь повышенную влажность.
На второй стадии вводятся в/м антигистаминные препараты: супрастин 2 % раствор или пипольфен 2,5 % раствор в разовых дозах детям до 1 года – 0,2–0,25 мл, 1–5 лет – 0,3–0,5 мл, 6–12 лет – 0,5–1 мл. Преднизолон внутрь 1–2 мг/кг/сут. Кокарбоксилаза 25–50 мг в/м.
На третьей стадии крупа показаны в/м введение преднизолона, ингаляция увлажненного кислорода. Применение седативных препаратов противопоказано, так как беспокойство является симптомом гипоксии.
При неэффективности консервативного лечения стеноза второй стадии в течение 12 часов больным с третьей стадией при отсутствии эффекта от терапии, а также всем больным с четвертой стадией показана эндотрахиальная интубация. При невозможности ее выполнения назначается крикотомия или трахеотомия.
Больных с первой стадией крупа можно лечить дома. Вторая стадия может быстро прогрессировать до четвертой, поэтому она требует тщательного наблюдения, при недостаточном эффекте от терапии показана госпитализация.
Нейротоксикоз
Нейротоксикоз развивается у детей младшего возраста при различных заболеваниях (ОРЗ, пневмония и др.).
В результате непосредственного воздействия инфекционного агента, токсинов на ткань мозга возникает генерализованная реакция, сопровождающаяся неврологическими расстройствами, нарушениями кровообращения, терморегуляции, кислотно-основного состояния. Морфологической основой нейротоксикоза является развитие метаболических нарушений в ткани мозга, выраженных сосудистых нарушений вплоть до отека и набухания мозга.
Клиника. В течении нейротоксикоза различают две фазы.
Первая фаза. Преобладают симптомы возбуждения центральной нервной системы. Ребенок в сознании, возбужден, беспокоен. Наблюдаются общая гиперестезия, тремор конечностей, стереотипные движения рук, ног. Обязательно имеет место гипертермия (температура тела выше 38 °C). Кожа розовая. Тоны сердца громкие. Тахикардия, небольшая одышка. Длительность фазы – до нескольких часов.
Вторая фаза. Преобладают симптомы угнетения центральной нервной системы. Ребенок вял, сонлив. Сознание угнетено, степень его нарушения различна – от сомнолентного до коматозного. Для общей оценки нарушения сознания можно использовать шкалу Глазго (табл. 9). Резкая гипертермия. Судороги клонические, клонико-тонические, тонические. Могут наблюдаться явления менингизма (выбухание, напряжение большого родничка, ригидность затылочных мышц). Кожа бледно-серого цвета. Несмотря на гипертермию, холодные руки и ноги. Тахикардия, затем брадикардия. Тоны сердца глухие. Олигурия.
Таблица 9
Шкала Глазго для оценки состояния ЦНС

При определении уровня сознания по шкале комы Глазго каждую реакцию оценивают в баллах. Общая оценка получается путем сложения баллов по каждой из трех групп признаков. Уровень сознания выражается суммой баллов. Оценка менее 9 баллов свидетельствует о тяжелом повреждении ЦНС.
Нейротоксикоз необходимо дифференцировать с фебрильными судорогами, спазмофилией, эпилепсией, кровоизлиянием в мозг, энцефалитом, менингитом, объемным процессом в мозге и др.
Для дифференцирования с менингитом производится люмбальная пункция, во избежание дислокации мозга жидкость выпускается только частыми каплями. Судорожный синдром, обусловленный гипокальциемией, наблюдается у детей 6 месяцев–2 лет больных спазмофилией, в зимне-весенний период. Типичный ее признак – симметричные карпонедальные тонические судороги, сознание не нарушается. Для дифференциального диагноза со спазмофилией всем детям с судорожным синдромом необходимо определить симптомы Хвостека, Люста, наличие которых свидетельствует о повышенной механической чувствительности нервов, наблюдаемой при гипокальциемии.
Судороги при гипокалиемии тонического характера, резко болезненны, не сопровождаются утратой сознания, обычно возникают в икроножных мышцах. Причина их – низкое содержание калия в плазме крови, обусловленное быстрым и резким обезвоживанием (понос, рвота).
Фебрильные судороги развиваются на фоне сохраненного сознания, могут возникнуть в начале или на высоте температурной реакции: кратковременные (меньше 10–15 минут), клонические, реже клонико-тонические, склонные к рецидивам, наблюдаются у детей от 6 месяцев до 5 лет.
При энцефалите имеют место: расстройство сознания, клонико-тонические или тонические судороги; появляются очаговые поражения (парезы, параличи, патологические рефлексы); температура субфебрильная, но может быть и нормальная.
Лечение определяется фазой заболевания, степенью повреждения ЦНС и включает мероприятия, направленные на ликвидацию гипертермии, отека мозга, нарушений функций сердечно-сосудистой и дыхательной систем. Для снижения температуры тела последовательно используют фармакологические средства и физические методы охлаждения. Назначают центральные антипиретики: 50 % раствор анальгина в дозе 0,1 мг/год жизни, в/м, в сочетании с антигистаминными препаратами (1 % раствор димедрола или 2 % раствор супрастина в/м в дозе детям до 1 года – 0,15–0,25 мл, от 1 года до 5 лет – 0,25–0,5 мл).
В I фазе можно ограничиться назначением центральных антипиретиков внутрь: парацетамол в разовой дозе до 1 года – 0,025–0,05–0,1 г, после года – 0,15–0,2–0,5 г 2–3 раза в сутки. Пипольфен, супрастин назначают внутрь в разовой дозе детям до 1 года – 0,002–0,006 г, от 2 до 5 лет – 0,008–0,01 г, 6–14 лет – 0,015–0,025 г (пипольфен таблетки 25 мг, супрастин таблетки 25 мг: детям до 1 года – по 1/4 таблетки, от 1 года до 6 лет – по 1/3 таблетки, от 7 до 14 лет – по 1/2–1 таблетке) 2–3 раза в день.
Для снятия спазма периферических сосудов и увеличения теплоотдачи антипиретики можно сочетать с папаверином в разовой дозе детям первого года жизни – 0,002–0,005 г, старшим детям – 0,01–0,03 г или с дибазолом в дозе 0,001–0,005 г в зависимости от возраста 2–3 раза в день.
Физические методы охлаждения могут быть использованы только после применения лекарственных средств, уменьшающих спазм сосудов кожи и воздействующих на центры теплорегуляции, иначе охлаждение будет только усиливать гипертермию! Ребенка надо раскрыть, на голову положить салфетку, смоченную холодной водой, или пузырь со льдом на некотором расстоянии от головы. Обтирать кожу спиртом, водкой до появления гиперемии, обдувать вентилятором, положить холодные салфетки на сосуды и в паховую область.
Нейроплегический эффект может быть достигнут применением седуксена, дроперидола, оксибутирата натрия. В первой фазе седуксен назначают внутрь по 1/4 таблетки – детям до 1 года и по 1/2 таблетки – детям 1–5 лет (таблетки по 5 мг). Во второй фазе при наличии судорог седуксен вводят в/м, 0,5 % раствор в дозе: детям до 1 года – 0,05–0,1 мл, 1–5 лет – 0,15–0,5 мл или в/в медленно, 0,5–2 мл в зависимости от возраста в 10 % растворе глюкозы (разовая доза седуксена 0,25–0,3 мг/кг). Используется также 0,25 % раствор дроперидола в дозе 0,5–1 мл в/м или в/в (0,1 мг/кг). После в/в введения максимум действия наступает через 20 минут, после в/м – через 40–60 минут. Хороший противосудорожный эффект дает ГОМК (оксибутират натрия) в разовой дозе 70–100 мг/кг в/в, медленно, в 10 % растворе глюкозы.
Для улучшения обменных процессов в клетках мозга применяют ноотропил по 50–100 мг/кг/сут.
Для борьбы с отеком мозга используют глюкокортикоидные гормоны – преднизолон в дозе 2–5 мг/кг/сут, в/м и/или в/в.
Для улучшения микроциркуляции и профилактики ДВС синдрома в комплекс терапии включают трентал в дозе 5–10 мг/кг/сут или курантил 1,5–5 мг/кг в сутки, никотиновую кислоту 0,005–0,01 г 2–3 раза в день.
Основу дегидратационной терапии составляет лазикс в разовой дозе 1 мг/кг в/м. Для уменьшения ацидоза назначают кокарбоксилазу 50 мг, в/м или в/в.
Антибактериальная терапия – антибиотики цепоринового ряда, макролиды и др. Лечение основного заболевания.
Кишечный токсикоз
Кишечный токсикоз развивается у детей раннего возраста, в основном при острых кишечных инфекциях – колиинфекции, сальмонелезе, дизентерии и др., характеризуется развитием интоксикации и обезвоживания организма, наступающего в результате потерь большого количества жидкости с рвотой и поносом.
Заболевание чаще возникает у детей, находящихся на неправильном искусственном вскармливании, имеющих неблагоприятный преморбидный фон (рахит, гипо– или паратрофия, экссудативный диатез и др.).
В зависимости от потери организмом преимущественно жидкости или солей выделяют три вида эксикоза:
1) внутриклеточное обезвоживание – вододефицитное;
2) внеклеточное обезвоживание – соледефицитное;
3) вне– и внутриклеточное обезвоживание – изотоническое.
Вид обезвоживания находит отражение в клинической и биохимической картине заболевания (табл. 10).
Таблица 10
Дифференциально-диагностические признаки внутриклеточного и внеклеточного обезвоживания (Э. К. Цыбулькин, 1998)

Обезвоживание организма ведет к уменьшению ОЦК, ухудшению реологических свойств крови и как следствие к развитию гипоксии, метаболического ацидоза и других нарушений обмена веществ.
Клиника. В зависимости от выраженности интоксикации и водно-электролитных нарушений в клинической картине кишечного токсикоза различают три стадии токсикоза и три степени эксикоза.
Первая стадия токсикоза – гиперкинетическая. Ребенок возбужден, беспокоен. Рвота. Жидкий, частый стул. Тахикардия. Развивается эксикоз первой степени, для которого характерна потеря массы тела до 5 %. Наблюдается умеренная жажда, слизистые суховатые. Тургор тканей нормальный.
Вторая стадия токсикоза – сопорозно-адинамическая. Ребенок вялый, адинамичный. Возможно нарушение сознания – сомнолентное или сопорозное. Сопровождается развитием эксикоз второй степени: потеря от 5 до 10 % массы тела, выражена сухость кожи и слизистых оболочек, тургор тканей снижен, большой родничок запавший, тахикардия, артериальное давление понижено, диурез снижен. Частая рвота, стул до 10 и более раз в сутки.
Третья стадия токсикоза – сознание утрачено. Появляются беспорядочные движения пальцев рук. Эксикоз третьей степени – потеря свыше 10 % массы тела. Слизистые оболочки сухие, губы сухие, яркие, черты лица заострены, кожная складка не расправляется в течение 2–3 минут, значительная одышка, тахи– или брадикардия. Артериальное давление резко снижено, тоны сердца глухие, анурия, парез кишечника.
Лечение. Его проводят с учетом степени выраженности токсикоза и эксикоза характера водно-электролитных нарушений. До начала регидратации при наличии рвоты следует промыть желудок физиологическим раствором или 1–2 % раствором натрия гидрокарбоната. Количество жидкости для промывания у детей до 1 года – 100 мл на каждый месяц жизни, от 1 года до 3 лет – 1,5–2 л.
Регидратацию начинают немедленно после установления диагноза, объем вводимой жидкости и методы ее введения зависят от степени эксикоза и возраста ребенка (табл. 11).
Таблица 11
Расчет объема жидкости для введения детям с кишечным токсикозом и эксикозом

При первой степени эксикоза проводят регидратацию, назначая жидкость внутрь. Ребенку дают 5 % раствор глюкозы, чай, специальные глюкозо-солевые растворы – оролит (состав: глюкоза – 20 г, натрия хлорид – 3,5 г, натрия гидрокарбонат – 2,5 г, вода – 1 л) и регидрон (состав: натрия хлорид – 3,5 г, калия хлорид – 2,5 г, лимонно-кислый натрий – 2,9 г, глюкоза – 10 г, вода – 1 л). Глюкоза, являющаяся составной частью регидратационных растворов, улучшает всасывание солей и воды в тонком кишечнике даже в тех случаях, когда в нем имеется воспалительный процесс. Если необходимо экстренно приготовить раствор в домашних условиях, глюкозу можно заменить сахаром, натрия хлорид – поваренной солью, натрия гидрокарбонат – питьевой содой. Раствор дают медленно, небольшими порциями, чтобы избежать рвоты.
При второй степени обезвоживания половину жидкости вводят в/в и половину дают внутрь в виде чая с лимоном, 5 % раствора глюкоза, глюкозольных растворов.
При третьей степени обезвоживания всю жидкость вводят внутривенно.
При изотонической дегидратации объем коллоидных растворов в общем количестве вводимой жидкости должен составлять 1/3 (5 % раствор альбумина, реополиглюкин); 2/3 вводимого раствора составляют 10 % раствор глюкозы с инсулином и калием; раствор Рингера.
При гипертоническом обезвоживании показано применение только изотонических растворов.
При гипотоническом обезвоживании вначале лечения для восстановления ОЦК вводят 5–10 % раствор альбумина, реополиглюкин в дозе 10 мг/кг. Затем глюкозо-солевые растворы. Скорость инфузии в первый час введения раствора – 30 мл/кг, в последующие часы – 10–20 мл/кг.
При наличии судорог следует в/в ввести седуксен или натрия оксибутират.
Учитывая полиэтиологичность кишечных инфекций, до установки этиологического диагноза необходимо начать антибиотикотерапию с парентерального введения левомицетина сукцината в дозе 25–30 мг/кг/сут, дозу делят на две инъекции в/м.
При выраженном токсикозе используют глюкокортикоидные гормоны – преднизолон 1–3 мг/кг/сут или гидрокортизон – 3–7 мг/кг/сут. Можно также применять ингибиторы протеаз – трасилол или контрикал в дозе 500 ЕД/кг/сут в 50 мл физиологического раствора в/в, 60 капель в 1 минуту.
Для восстановления обменных процессов назначают витамины С (300 мг/сут), В1 (20–30 мг), В6 (25–30 мг), кокарбоксилазу (50 мг/сут).
Регидратация – введение водно-солевых растворов – может быть закончена после прекращения рвоты, ликвидации олигурии и других признаков эксикоза.
После исчезновения симптомов интоксикации и эксикоза для нормализации флоры кишечника назначают биопрепараты – лактобактерин, бифидумбактерин, бификол, бактисубтил, линекс.
Диета. В острый период токсикоза – водно-чайная диета на 16–24 часа. Затем дозированное дробное кормление – детям до 6 месяцев назначают 10 кормлений (через 2 часа с ночным перерывом в 4 часа) по 10–20 мл грудного молока или адаптированной смеси. В последующие дни объем питания увеличивают на 10–20 мл на одно кормление. При достижении суточного объема 500 мл ребенка переводят на 8-разовое кормление по 70–80 мл, через 2–3 дня – на 7-разовое по 100–120 мл и 6–5-разовое кормление. В последующие дни ребенка переводят на физиологическое питание. Во время дробного кормления недостающий по возрасту объем пищи восполняется питьем глюкозо-солевых растворов, чая.
Детям более старшего возраста после водно-чайной диеты на 1–3 дня назначают щадящую диету малыми порциями, каждые 3–4 часа: жидкие каши, кисели, кефир. Затем диету расширяют, вводят творог, мясное суфле, овощное пюре, овощные супы.
Судорожный синдром
Судорожный синдром – одна из универсальных реакций организма, возникающая при многих патологических процессах, реализующаяся в виде внезапно наступающего приступа непроизвольных сокращений мышц (судорог) клонического, тонического или клонико-тонического характера, протекающая с потерей или без потери сознания.
Выяснить причины возникновения судорожного синдрома у детей нередко бывает очень сложно, так как чем младше ребенок, тем выше у него судорожная готовность из-за незрелости мозга и тем чаще у него могут возникнуть судороги при самых различных патологических процессах.
Наиболее частыми причинами судорог у новорожденных детей являются асфиксия, внутричерепные родовые травмы, гипогликемическое состояние, внутриутробная инфекция.
Судороги у детей грудного возраста наблюдаются при пороках развития головного мозга (гидроцефалия, микроцефалия и др.).
Фебрильные судороги у детей в возрасте от 4–6 месяцев до 4–6 лет возникают в начале лихорадки или на высоте подъема температуры тела, кратковременные (несколько минут), генерализованные, клонико-тонические, как правило, не сопровождаются потерей сознания.
Судороги при нейротоксикозе, заболеваниях, протекающих с поражением мозговых оболочек (менингитах), вещества мозга (энцефалитах) или с явлениями менингизма.
Менингизм – менингиальный синдром, возникающий при ряде соматических заболеваний (пневмонии, ОРЗ, пиелонефрите и др.) в результате раздражения мозговых оболочек за счет интоксикации, отека мозга.
Судороги при нарушении минерального обмена – гипокальциемии, гипокалиемии, гипомагниемии.
Тетания – заболевание, обусловленное снижением содержания ионизированного кальция в крови, вызванное либо гипопаратиреозом, либо спазмофилией и проявляющееся ларингоспазмом, карпогидальным спазмом, приступом эклампсии.
У детей школьного возраста судорожный синдром встречается реже, чем у детей грудного возраста, и обусловлен нейроинфекцией или может наблюдаться при коматозных состояниях, объемных процессах в головном мозге, отравлениях.
В любом возрасте возможны судороги при эпилепсии. Генерализованный общий судорожный припадок проявляется клонико-тоническими судорогами в конечностях, сопровождается утратой сознания, пеной у рта, часто прикусом языка, непроизвольным мочеиспусканием. Припадок длится 2–3 минуты, сменяется коматозным состоянием, переходящим в глубокий сон. Если кома не сменяется сном, то сознание постепенно восстанавливается, может быть полная амнезия припадка.
Судороги, обусловленные гипоксическим повреждением ЦНС, могут также возникнуть у детей любого возраста.
При оказании неотложной помощи в первую очередь необходимо снять судорожный синдром.
В табл. 12 приведена характеристика основных противосудорожных препаратов, используемых для купирования генерализованных судорог.
Таблица 12
Характеристика противосудорожных препаратов (Э. К. Цыбулькин, 2000)


После снятия судорог необходимо прежде всего попытаться установить причину их возникновения. При наличии симптомов менингизма нужна люмбальная пункция, так как без исследования спинномозговой жидкости распознать менингит, дифференцировать его от субарахноидального кровоизлияния или от менингизма практически невозможно.
Для купирования судорожного синдрома при эпилепсии применяют диазепам (седуксен) в/в или в/м в дозе 2–10 мг. При эпилептическом статусе введение препарата можно повторить через 2 часа, затем через 4 часа. Для купирования или предупреждения развития отека мозга после серии судорожных препаратов и эпилептического статуса показано применение фуросемида.
Сразу после купирования судорог принимают меры к устранению дыхательной недостаточности, которая может быть не только причиной судорог, но и их следствием.
Головная боль
Головная боль – симптом, встречающийся при многих заболеваниях, всегда требует к себе очень внимательного отношения, так как может быть начальным проявлением тяжелой патологии – менингитов, энцефалитов, опухолей головного мозга и др. В то же время головная боль может возникнуть у эмоционально-лабильных детей при переутомлении, длительном просмотре телевизионных передач и др.
Головная боль возникает в результате раздражения зон головного мозга, обладающих болевой чувствительностью (твердая мозговая оболочка, устья крупных сосудов, впадающих в мозговые синусы, чувствительные волокна V, VII, IX, X пар черепно-мозговых нервов, заканчивающихся в мозге), при увеличении объема мозга (отек, опухоли), повышении или снижении давления спинномозговой жидкости, полнокровии или ишемии мозга, воздействии токсинов.
Головная боль как симптом интоксикации наблюдается при многих заболеваниях (пневмонии, ОРЗ и др.), выраженность и продолжительность ее зависят от степени интоксикации.
Головные боли при артериальной гипертонии нередко являются одним из первых симптомов таких заболеваний, как феохрамоцитома, коартация аорты, аномалии сосудов почек, гломерулонефрита и др., могут наблюдаться у детей любого возраста.
При объемных процессах в мозге (опухоли, абсцесс мозга и др.) одним из ранних симптомов является постепенно нарастающая головная боль, нередко сопровождающаяся рвотой, локальные симптомы могут выявиться позже.
Посттравматические головные боли наблюдаются у многих детей, перенесших черепно-мозговую травму. Как правило, они возникают при физической нагрузке, умственном напряжении, езде в транспорте, могут сопровождаться тошнотой, рвотой.
При нарушении аккомодации и аномалии рефракции головные боли нередко возникают после чтения «мелкой» работы, требующей напряжения зрения, просмотра телепередач.
Мигрень – наследственно обусловленное заболевание, характеризующееся периодически возникающими приступами головных болей, которые чаще наблюдаются у школьников. Боль может начаться в любое время суток, постепенно усиливается, иногда начинается в одной половине головы. Характер боли часто пульсирующий, возможно присоединение тошноты, рвоты. Яркий свет, резкие запахи, звуки могут способствовать усилению головной боли. Продолжительность приступа мигрени – от нескольких часов до 1–2 суток.
Головная боль может развиться при воспалении пазух носа. Локализация ее будет зависеть от пораженного синуса: при фронтите – в лобной области, при гайморите – в области скул, при сфеноидите – в области затылка. Наряду с головной болью наблюдаются и другие симптомы синуситов – слизисто-гнойные выделения из носа, припухлость мягких тканей (верхнего века при фронтите, нижнего – при гайморите) и др.
На наличие головной боли ребенок может пожаловаться начиная с 3–5-летнего возраста. Дети более старшего возраста уже могут более точно указать ее локализацию и характер (пульсирующая, постоянная и др.). У детей раннего возраста косвенным указанием на головную боль могут служить немотивированное беспокойство, вскрикивание или монотонный крик.
При наличии жалоб на головную боль необходимо тщательно обследовать ребенка, чтобы установить ее причины. Лечение будет зависеть от заболевания, симптомом которого явилась головная боль.
Лечение. При лечении мигрени используют никотиновую кислоту, никотинамид (таблетки по 0,025 г), баралгин (таблетки по 500 мг), цитрамон по 1/4–1/2–1 таблетке в зависимости от возраста 2–3 раза в день, калпол (парацетамол, суспензия детская 120 мг/5 мл) детям 6–12 лет в дозе 10–20 мл до 4 раз в день. После снятия приступа головной боли назначают настойку валерианы, успокоительный сбор № 3 по 1/4–1/3 стакана в сутки за 30 минут до еды в течение 10–14 дней, гидротерапию.
Обморок
Обморок – синко́па (греч. syncopе́, букв. «обрубание») – кратковременная утрата сознания, обусловленная острой гипоксией мозга вследствие уменьшения его кровоснабжения.
Малокровие мозга может быть результатом уменьшения сердечного выброса и/или кратковременного снижения тонуса сосудов.
В основе обмороков, возникающих при сильных душевных волнениях, испуге, виде крови, пребывании в душном помещении, экстракции зуба и др., лежит рефлекторное снижение сосудистого тонуса в ответ на психогенные или внешние факторы.
Ортостатический обморок возникает при резкой перемене положения тела – быстром переходе из горизонтального положения в вертикальное. Особенно часто наблюдается он у подростков и обусловлен вегетодистонией, в результате которой в вертикальном положении происходит быстрое и значительное расширение артериол, уменьшение периферического сопротивления без обычного компенсаторного увеличения сердечного выброса.
Обморок может возникнуть вследствие гипервентиляции – усиленного дыхания, приводящего к понижению напряжения углекислоты в альвеолярном воздухе и развитию гипокапнии, следствием которой является понижение тонуса сосудодвигательного центра, регулирующего тонус артериол и вен, а также ослабление сосудорасширяющего эффекта углекислоты на мозговые сосуды.
Обморок при гипогликемии обусловлен нарушением церебрального метаболизма в результате нарушения энергетического обеспечения мозга.
Обмороки, в патогенезе которых ведущая роль принадлежит нарушениям деятельности сердца, делятся на две группы, обусловленные: 1) расстройством сердечного ритма и проводимости; 2) снижением сердечного выброса.
К первой группе относятся обмороки при полной атриовентрикулярной блокаде, возникшей на почве органического или функционального нарушения проводящей системы сердца и развивающегося при этом синдрома Морганьи – Адамса – Стокса. Обморок возникает обычно, когда частота сердечных сокращений снижается до 35 и ниже в 1 минуту. Они могут возникнуть при выраженной брадиаритмии у больных с синдромом слабости синусового узла, а также при нарушении работы постоянного кардиостимулятора. При синдроме удлиненного интервала Q – T на ЭКГ обморок возникает при физической нагрузке, эмоциональном напряжении и др.
Вторую группу составляют обмороки, связанные с недостаточным поступлением крови в аорту (вследствие уменьшения систолического и минутного объема кровообращения) при выраженном аортальном стенозе или при наличии шаровидной опухоли в левом сердце.
Клиника. Она складывается из субъективных и объективных признаков. Внезапно наступают общая слабость и ощущение «дурноты», выражающиеся в головокружении, потемнении в глазах, нарушении равновесия, иногда появляются зевота, тошнота, шум в ушах. Больной теряет сознание и падает. Отмечаются резкая бледность кожи, похолодание конечностей, холодный пот, малый, редкий пульс, падение артериального давления.
Продолжительность обморока – от нескольких секунд до нескольких минут.
Неотложная помощь. Больного необходимо уложить на спину с приподнятыми ногами, освободить от стесняющей одежды. Лицо обрызгать холодной водой, дать понюхать нашатырный спирт, одеколон.
При обмороках, связанных с нарушениями ритма, – лечение аритмий.
Всем детям с обморочными состояниями необходимо ЭКГ-обследование, чтобы выявить нарушения сердечного ритма и синдром удлиненного интервала Q – T.
Боль в суставах (артралгия)
Артралгия – суставная боль – может быть субъективным симптомом без объективных признаков поражения суставов как одно из проявлений инфекционно-токсического заболевания (гриппа, ОРЗ, хронического тонзиллита и др.) или входить как составляющая в суставный синдром при инфекционно-воспалительных, аллергических, дистрофических и других артритах.
Независимо от этиологии общими симптомами для всех артритов являются: отечность в области пораженного сустава, гиперемия кожи над ним, болезненность и ограничение движений, нередко повышение местной кожной температуры.
Наиболее часто наблюдаются артриты, обусловленные инфекцией. Их делят на инфекционные и реактивные. При инфекционных артритах в полости сустава обычно находят инфекционный агент. Вызываются они бактериальной, вирусной и другой инфекцией. При реактивных артритах инфекционный агент в полости сустава отсутствует. Часто реактивный артрит развивается после энтероколитов (дизентерии, сальмонеллеза, персинеоза и др.). Для реактивных артритов характерна асимметричность поражения суставов.
Артриты аллергической этиологии наблюдаются при сывороточной болезни, тяжелой крапивнице. Для них характерны выраженность проявлений в период кожных высыпаний и быстрое обратное развитие всех симптомов при общем улучшении состояния.
Ревматический полиартрит наблюдается у 50 % больных ревматизмом детей. Начинается он остро, чаще через 2–3 недели после перенесенного стрептококкового заболевания (ангины и др.) и является одним из первых проявлений ревматической атаки. Для ревматического полиартрита характерны симметричность поражения крупных и средних суставов (коленных, голеностопных, лучезапястных), летучесть поражения суставов, быстрый эффект от применения противовоспалительных препаратов. Все явления артрита проходят бесследно. При ревматизме вместо полиартрита может наблюдаться полиарталгия.
Ювенильный ревматоидный артрит – иммунологические заболевания суставов, суставная форма составляет 75–80 %, суставно-висцеральная – 20–25 %. Развитию заболевания могут предшествовать длительные жалобы на артралгию, затем присоединяются моно-, олиго– или полиартрит. При суставной форме чаще поражаются средние суставы (коленные, голеностопные, лучезапястные), могут страдать и суставы кистей. Важным симптомом наряду с деформацией суставов является утренняя скованность.
Артралгии часто являются первым симптомом и других диффузных болезней соединительной ткани (системная красная волчанка и др.).
Лечение. При наличии жалоб на боли в суставах или появлении симптомов артрита необходимо тщательно обследовать больного, чтобы установить этиологии заболевания. Независимо от причин возникновения артралгии или артрита в качестве первой помощи больному назначают анальгетики (парацетамол, анальгин) или нестероидные противовоспалительные препараты – НПВП (табл. 13) для уменьшения болевого синдрома и подавления воспаления.
Таблица 13
Характеристика нестероидных противовоспалительных препаратов

Однако выбор конкретного НПВП бывает затруднен, поскольку механизмы противовоспалительного действия НПВП многообразны. Наиболее важные из них – уменьшение проницаемости капилляров, ограничение экссудативного компонента воспаления, стабилизация лизосомальных мембран, торможение выработки АТФ, способствующее угнетению воспаления, торможение синтеза или инактивация медиаторов воспаления (таких, как простагландины, гистамин, серотонин и др.), цитостатическое действие, приводящее к торможению пролиферативной фазы воспаления, угнетение агрегации тромбоцитов. Все НПВП обладают также болеутоляющим и жаропонижающим действием.
Группа НПВП включает салицилаты (аспирин), производные пиразолона (бутадион), производные ряда органических кислот (артофен, вольтарен, ибупрофен, напроксен, кетопрофен, индометацин, сургам и др.).
Выбор НПВП, его дозу и способ введения подбирают для каждого больного индивидуально, с учетом выраженности болевого синдрома, возможности возникновения побочных эффектов (см. табл.13).
При резких суставных болях в первые дни лечения можно назначить анальгетики в/м.
Выраженным противовоспалительным и обезболивающим действием обладают индометацин, вольтарен, диклофенак, ибупрофен и др. В случае отсутствия эффекта от терапии в течение 7–10 дней один НПВП заменяют на другой.
Кратность приема НПВП зависит от периода их полувыведения. Препараты с коротким периодом полувыведения (до 8 часов) назначают 3–4 раза в сутки (индометацин, ибупрофен, аспирин) с длительным периодом полувыведения (пироксикам) 1 раз в сутки.