Вступление
Очередная модная диета?
Кетоз был с человечеством на протяжении миллионов лет, но кето именно как диетический протокол сегодня переживает своего рода ренессанс.
История кетоза начинается с истоков нашей эволюции. Первобытный человек был верховным хищником последние два миллиона лет [1, 2]. Это значит, что в приоритете питания наших далеких предков всегда были мясо, субпродукты и жир животных. Он понимал: именно эти продукты дают максимальную сытость, энергетическую ценность и все необходимые питательные вещества, позволяющие выжить и иметь здоровое потомство.
Углеводы, конечно же, были, но их количество значительно варьировалось в течение года, и все они были сложными, нерафинированными. Они содержались в кореньях, корнеплодах, орехах, травах, листьях и ягодах и не могли сравниться со сладкими, сочными продуктами селекционного отбора и генной инженерии, которые мы покупаем в любом магазине вне зависимости от сезона, и тем более не идут в сравнение с рафинированными углеводами (макаронами, хлебом, мукой, белым сахаром).
Качество растительной пищи также кардинально отличалось от современных продуктов: они были максимально свежими, то есть содержали огромное количество полезных веществ, и максимально чистыми, потому что росли без химикатов.
Процент углеводной пищи в рационе древнего человека зависел от широты, в которой он проживал [3]: в северных широтах доступ к углеводам был строго ограничен короткими летними периодами и животных продуктов было больше, тогда как ближе к экватору преобладали растения, но жир и сладкое (мед и фрукты) ценились больше всего. Почему? Потому что периоды изобилия неизменно чередовались с периодами голода [4].
В периоды изобилия простых углеводов и особенно фруктозы, да и любой пищи в целом, люди запасали энергию впрок. Наши жировые запасы – это прежде всего запасы энергии и витаминов, которые позволяли нашим предкам выжить! Именно поэтому мы так обожаем комбинацию жирного и сладкого и так легко от нее толстеем [5].
К сожалению, исчезновение крупных животных (так называемой мегафауны) в различных частях мира и сокращение источников животной пищи к концу каменного века (примерно 85 000 лет назад в Африке и 40 000 лет назад в Европе и Азии) привели к тому, что у людей не было другого выбора, кроме как стать фермерами [6].
С появлением сельского хозяйства и культивируемого зерна около 10 000 лет назад питание значительно изменилось и выживать стало значительно легче. Размер мозга и средний рост человека уменьшились, а здоровье ухудшилось. По сути, процесс строгого селекционного отбора, который многие сотни тысяч лет «ковал и оттачивал» наши гены, закончился именно на этом этапе [5].
И самое главное: относительно недавно – всего лишь секунда в эволюции человека – с начала XX века люди получили легкий доступ к продуктам питания, произведенным на фабрике, а в частности – к простым, рафинированным углеводам и рафинированным растительным маслам, выжатым из семян. Одновременно с этим запретили есть жир и внушили страх перед холестерином и красным мясом, которые раньше играли такую важную роль в эволюции. Питание в рекомендациях, диктуемых Минздравом и современной диетологией, разительно отличается от того, что ели наши предки [6, 7].
Несмотря на некоторые изменения в геноме человека, произошедшие за последние 10 000 лет и обусловленные в том числе резким ростом и распространением населения по всему земному шару, наши гены, связанные с метаболизмом жиров и углеводов, по большей части не изменились и работают точно так же, как они это делали до внедрения сельского хозяйства [8, 9]. А это значит, что для правильной работы организма нужно питаться так же, как это делали охотники-собиратели. Именно такой стиль питания оптимален для здоровья.
Более того, ученые, занимающиеся эпигенетикой, обнаружили: современный образ жизни – низкая физическая активность, мусорное питание, а также токсины окружающей среды – могут сильно влиять на экспрессию наших генов. Питание способно включать и выключать определенные гены – от онкогенов до генов долголетия [10]. Те гены, которые мы наследуем от наших родителей, – это всего лишь вершина айсберга, а его основу составляет наш образ жизни и, в частности, питание.
Поймите: гены – это не приговор! Мы можем влиять на них едой, поэтому здоровье напрямую зависит от качества и состава пищи [11].
При чем тут кетоз? Как мы уже упоминали, древний человек периодически оставался без еды. Иногда эти периоды были довольно длительными. Дело в том, что запасов глюкозы в нашем организме чрезвычайно мало – их хватает максимум на сутки. Поэтому в более длительные периоды голода, то есть когда в организм не поступало никакой еды, он переключался на другой источник энергии – кетоны, используя собственные жировые запасы, сформированные в периоды изобилия. Именно поэтому практически в каждой нашей клеточке заложены эти важные механизмы – механизмы кетоза [12]. Именно кетоны помогают не умереть от голода и слабости, а наоборот, дают нам необходимые силы и ясность мозга, чтобы придумать, как раздобыть еду. Те из вас, кто голодал более двух суток, знают: внезапно вместо слабости и усталости появляется энергия, и мозг работает лучше, происходит своего рода «просветление». Это начинают вырабатываться и использоваться кетоны!
То же самое происходит, когда мы ведем образ жизни, похожий на образ жизни охотников-собирателей: много двигаемся, потребляем только сложные углеводы, не вызывающие сильных скачков гормона инсулина (каковыми являлись большинство древних источников углеводов) и соблюдаем пищевые паузы, то есть не кусочничаем и не перекусываем. Поскольку поступающей глюкозы мало и она быстро расходуется, можно с уверенностью сказать: наши предки по большей части «работали на кетонах», особенно предки обладателей светлой кожи – они жили в северных широтах и не имели доступа к углеводам поздней осенью и зимой.

Но самое главное: древние люди постоянно и легко чередовали периоды кетоза и углеводного метаболизма в зависимости от сезона.
Важно заострить ваше внимание на том, что никогда за всю историю нашей эволюции человек не испытывал нужды в постоянных высокоуглеводных подзаправках, которые принято считать необходимыми для того, чтобы уровень сахара в крови не падал и для оптимальной работы мозга и роста мышц. И тем более таких продуктов просто не было в его окружении. Все было с точностью до наоборот! Быстрые углеводы были редким удовольствием и нужны с одной целью – потолстеть, отложить энергию про запас.
Принцип питания наших предков можно выразить двумя емкими понятиями: «голод» и «пир». Что это значит? Они периодически голодали, но когда еда появлялась, то ели до полной сытости и, конечно же, не считали калории.
Во время периодов голода клетки имели возможность «очиститься»: запускались процессы внутриклеточного обновления [13]. Поэтому периоды голода, так называемые пищевые паузы, так же важны для здоровья, как и то, что мы едим.
Чтобы наши гены могли работать, как задумано эволюцией, важно дожидаться настоящего голода и есть досыта. Не менее важна также физическая активность.
На современной высокоуглеводной диете (а количество углеводов у среднего обывателя порой достигает 75 %, и далеко не все из них овощи!) длительные перерывы между приемами пищи практически невозможны: высокие углеводы вызывают значительное и избыточное повышение гормона инсулина, подавляющего глюкозу в крови, а постоянные перепады ее уровня провоцируют повышенный голод. Но на кето вполне естественным образом этот голод проходит, ведь даже если мы не потребляем пищу, наш организм знает, где взять нужную энергию – из собственных жировых запасов, точно так же, как это делали наши предки! Более того, сами кетоны притупляют чувство голода [14]. Пропускать приемы пищи становится легко, образуются естественные пищевые паузы, не требующие силы воли.
Таким образом, кето – это некий возврат к «заводским настройкам» организма, который с самого рождения умеет работать как на глюкозе, так и на кетонах, свободно чередуя источники энергии.
Многие боятся кетоза, не подозревая, что обычный человек даже на высокоуглеводном питании входит в умеренный кетоз под утро, если он пропустил ужин, или после интенсивной тренировки. Грудные дети легко и непринужденно чередуют периоды кетоза с углеводным метаболизмом [15, 16, 17], и только потом мы отнимаем у них эту способность, закармливая фруктовыми пюре, сладкими йогуртами и кашами.
Продолжая историю кетоза, но уже кетоза в медицинских целях, важно упомянуть о том, что великий Гиппократ, «праотец» медицинской науки, заметил, что голодание лечит приступы эпилепсии, еще в V веке до нашей эры: «Есть, когда ты болен, – это питать свою болезнь». «Вместо лекарств поголодай день», – говорил древнегреческий философ Плутарх.
Мы уже знаем, что голодание – это не что иное, как кетоз. И доказательств благотворного влияния лечебного голодания, то есть кетонов, в научной литературе множество [18]. Голодание как лекарство применялось с древних времен, и многие культуры до сих пор практикуют периоды очищения и восстановления во время постов. Но конечно же, бесконечно голодать нельзя.
Именно поэтому официально в качестве специального диетического протокола кетодиета появилась «на сцене» в 1923 году, когда американский врач доктор Рассел Вайльдер разработал в клинике Мэйо новый протокол для лечения эпилепсии. Он долго изучал преимущества голодания в немедикаментозном лечении эпилепсии и разработал диету, имитирующую голодание. Ее мы сегодня и называем классической кетодиетой, которую можно соблюдать гораздо дольше, чем лечебное голодание.
Таким образом, кетоз был с нами испокон веков, но с изобретением лекарств и появлением легкодоступной высокоуглеводной пищи мы про него забыли. А вспомнили только недавно, когда началась эпоха метаболического синдрома.
Метаболический синдром
Большинство людей в современном мире умирает от хронических болезней, которые можно предотвратить. Это заболевания сердечно-сосудистой системы, осложнения от диабета второго типа, онкология и нейродегенеративные заболевания (болезни Альцгеймера и Паркинсона). Число смертей от сердечных заболеваний во всем мире увеличилось более чем на два миллиона с 2000 года и составило девять миллионов в 2019 году. Смертность от диабета второго типа увеличилась на 70 % в период с 2000-го по 2019 год, при этом смертность среди мужчин выросла на 80 %!
Если верить данным Росстата, наиболее распространенная причина смерти россиян, по данным 2018 года, – болезни сердца и сосудов, на которые приходится 44 % от всех случаев среди мужчин и 49,5 % среди женщин. На втором месте онкологические заболевания (17,5 % среди мужчин, 15 % женщин) [35]. Особенно грозными считаются последствия диабета второго типа – они практически всегда способствуют ухудшению качества жизни. Смертность от этих причин постоянно и неуклонно растет.
Медицина, безусловно, не стоит на месте и способна продлить жизнь купированием симптомов, лекарствами и операциями, но качество нашей жизни – наш уровень энергии, активность и настроение, степень удовлетворенности нашим физическим обликом и самочувствием, отсутствие постоянных болей и периодического недомогания – при хронических заболеваниях, как правило, не улучшается. Люди живут дольше, но с большей инвалидностью и сниженным качеством жизни [19]. Преимущество долголетия без отличного самочувствия – это спорный вопрос.
Метаболический синдром (МС) – комплекс патологических отклонений, которые наблюдаются совместно и значительно повышают риск хронических заболеваний. Термин «метаболический» относится к биохимическим процессам, участвующим в нормальном функционировании организма.
Диагноз МС ставится при наличии как минимум трех критериев [20][2]:
• ожирение, окружность талии (>88 см у женщин и 102 см у мужчин);
• повышенное кровяное давление (>130/85 мм рт. ст.);
• высокая глюкоза натощак (>100 мг/дл, или 5,6 ммоль/л);
• высокие триглицериды (>1,69 ммоль/л, или 150 мг/дл);
• низкий холестерин ЛПВП (<1,03 ммоль/л, или 40 мг/дл у мужчин; <1,29 ммоль/л, или 50 мг/дл у женщин)[3].
Многочисленные исследования показывают, что метаболический синдром связан с удвоением риска сердечно-сосудистых заболеваний и пятикратным увеличением риска диабета второго типа [21].
Хронические заболевания, риск которых значительно повышается при МС, включают:
• заболевания сердечно-сосудистой системы: инфаркты, инсульты, ишемическая болезнь сердца [21];
• онкологические заболевания [24];
• болезнь Паркинсона [23], болезнь Альцгеймера [25,26];
• сахарный диабет второго типа [21];
• неалкогольная жировая болезнь печени (стеатоз, стеатогепатит, цирроз) [21];
• болезнь желчного пузыря, камни в нем [21];
• гиперкоагуляционный синдром, тромбозы, флебит [21];
• болезни репродуктивной системы [21]: синдром поликистозных яичников (СПКЯ), обильные менструации, бесплодие, андрогенодефицит, эректильная дисфункция;
• острый панкреатит [22];
• гиперурикемия и подагра [27];
• хроническая почечная недостаточность, микроальбуминурия [28];
• апноэ во сне [29];
• бронхиальная астма [30];
• катаракты [31];
• депрессия [32, 33];
• рассеянный склероз [34].
Теперь посмотрим, сколько россиян имеют выраженную метаболическую дисфункцию в той или иной степени. Исследований на эту тему мало, но и те, что есть, не обнадеживают.
К примеру, у 40 % жителей Новосибирска в возрасте 25–64 лет выявлено две и более составляющих метаболического синдрома [36]. А среди обследованных в 2010 году 42–70-летних жителей Сибири метаболический синдром выявлен у 89 % мужчин [37]
Проведенное в 2009 году С. Ю. Чубриевой обследование североевропейской этнической группы России показало наличие MC у 41 % девочек-подростков и у 70 % женщин репродуктивного возраста (неполный MC выявлен у 59 % и 30 % соответственно) [38].
На лечение связанных с МС заболеваний государства выделяют огромные средства, но, к сожалению, нередко оно проходит безуспешно: медикаментозно контролируются симптомы, но не убираются причины.
Из всех известных на данный момент возможных причин развития МС главными являются следующие.
1. Гиперинсулинемия или инсулинорезистентность – патологическое снижение чувствительности клеток к инсулину и избыточный его синтез. Гиперинсулинемия увеличивает количество циркулирующих свободных жирных кислот (СЖК) и играет ключевую роль в патогенезе метаболического синдрома [20, 39, 40, 41].
2. Ожирение, приводящее к нарушению работы гормонов лептина, адипонектина, ангиотензина II и повышению синтеза свободных радикалов. Принято считать, что ожирение – это следствие слабого контроля над своим пищевым поведением, переедания и нежелания заниматься спортом. Но немногие понимают, что именно гиперинсулинемия часто приводит к набору лишнего веса, вызывая компенсаторную гипогликемию (снижение уровня сахара в крови и, как следствие, голод) и последующее переедание и ожирение. Гиперинсулинемия нарушает сигналы голода и насыщения в нашем мозге, а ожирение и нарушение гормональных сигналов, в свою очередь, приводит к невозможности и нежеланию быть физически активным.
3. Хроническое неспецифическое воспаление – прямой результат ожирения и гиперинсулинемии, но может быть вызвано и другими причинами, например окисленными жирами омега-6.
Гиперинсулинемия прямо или косвенно способствует возникновению широкого спектра метаболических заболеваний, включая все воспалительные состояния, сосудистые заболевания, гестационный диабет и диабет второго типа, неалкогольную жировую болезнь печени, ожирение и некоторые виды рака и деменции [46]. Поэтому для того, чтобы справиться с МС и избежать большинства болезней современности, требуется привести в норму инсулин и улучшить чувствительность клеток к нему. И это можно сделать, не прибегая к дорогим лекарствам, а всего лишь изменив питание и образ жизни! [42]
Слишком много инсулина!
Инсулин – очень важный гормон. Он вырабатывается в поджелудочной железе и помогает глюкозе зайти в клетки мышц и адипоцитов (жира), где она превратится в энергию. Это снижает концентрацию глюкозы в крови и держит ее в норме.
Сигналы инсулина «слышат» все ткани нашего организма. Он отвечает за то, как клетки используют или запасают энергию, растут, синтезируют гормоны или ферменты, он даже может дать клетке сигнал «жить или умереть». Инсулин – это гормон роста, по-научному называемый анаболическим. В разных органах инсулин действует по-разному. Например, он вызывает формирование энергетических запасов глюкозы в печени (гликогена) и жировых депо; в мышцах он отвечает за использование энергии и стимулирует рост мышц, а в половых органах – синтез половых гормонов и так далее.
Но когда глюкозы поступает слишком много, а ее хранилище под названием гликоген уже переполнено и не расходуется (например, при низкой физической активности), инсулина выделяется все больше, чтобы «растолкать» избыток глюкозы по клеткам (потому что сахар в крови начинает повышаться, а это опасно для жизни). Чем больше вырабатывается инсулина на постоянной основе, тем хуже клетки его «слышат». Когда они «глухи» к сигналам инсулина, поджелудочная железа вынуждена производить еще большее его количество, чем прежде. Это и есть гиперинсулинемия, патологическое состояние, которое часто, но не совсем верно путают с инсулинорезистентностью. Гиперинсулинемия – это много инсулина, инсулинорезистентность – это когда клетки перестают его слышать.
К сожалению, многие даже не подозревают о том, что у них может быть хронически повышен инсулин, ведь анализ на инсулин не входит в плановое обследование: обычно измеряют только уровень глюкозы. А она в крови будет поддерживаться до последнего, тогда как уровень инсулина будет неуклонно расти. Поскольку глюкоза остается в норме долгое время, врач не сможет поставить диагноз вовремя. Это состояние называется преддиабет, оно способно развиваться десятилетиями без особых симптомов, закладывая фундамент многих хронических заболеваний. В итоге врач будет бить тревогу, только когда глюкоза в крови начнет повышаться, и поставит официальный диагноз – диабет второго типа. Но будет уже слишком поздно, хотя этот диагноз можно легко предупредить!
«Лечение» диабета второго типа оставляет желать лучшего: оно не убирает первопричину и сводится к тому, чтобы пить сахароснижающие препараты, а на поздних стадиях вкалывать инсулин, чтобы держать глюкозу в норме. Но растущее количество инсулина, уже вырабатывающееся организмом да и вводимое извне, не решает проблемы, а только усугубляет ее.
Доктор Бен Бикман, ведущий исследователь инсулина, пишет в книге «Почему мы болеем»: «Больше всего я жалею о том, что так много людей с гиперинсулинемией не диагностированы – мы смотрим на это неправильно. Возможно, если бы инсулин легче было измерить… мы могли бы запустить систему для выявления болезни намного раньше – все потому, что мы бы искали более актуальный показатель, инсулин. Неудивительно, что инсулин – гораздо более точный предиктор диабета второго типа, чем глюкоза, поскольку он позволяет предсказать проблему на двадцать лет раньше» [43].
Диабет второго типа приводит к серьезным осложнениям, таким как заболевания глаз, сердца, нервов, почек, органов пищеварения, ног, десен и системы кровообращения.
Это настоящая пандемия XXI века, и если раньше он считался болезнью старости, то сегодня мы встречаем его даже среди детей и младенцев [44].
Вместе с измерением уровня глюкозы критично важно измерять инсулин и натощак, и после приема пищи[4]. Этот анализ, который по праву должен стать «золотым стандартом» в ранней диагностике диабета, создал американский врач доктор Джозеф Крафт в 1975 году [45]. Он измеряет инсулин натощак и в течение 3–5 часов после введения 100 г глюкозы и способен выявить гиперинсулинемию за 24 года до того, как начнет повышаться глюкоза в крови! [46]. Некоторые фирмы, например датская Meterbolic, разрабатывают домашние тесты на инсулин, способные помочь решить проблему для миллионов людей с недиагностированным преддиабетом, – они должны сделать измерение инсулина таким же доступным, как и измерение глюкозы на дому.

Диабет первого типа тоже связан с инсулином, но по-другому: в этом случае он вообще не вырабатывается из-за повреждения поджелудочной железы, и человек должен делать инъекции инсулина, чтобы контролировать уровень сахара в крови.
1. Гиперинсулинемия вызывает повышенный синтез свободных радикалов и конечных продуктов гликации (AGEs), усиливая хроническое воспаление [43, 46].
2. Высокий уровень инсулина повышает кровяное давление и уровень воспаления в стенках сосудов, вызывает эндотелиальную дисфункцию и формирование атеросклеротических бляшек. Именно гиперинсулинемия вызывает нарушения липидного профиля. Это характеризуется повышением свободных жирных кислот и триглицеридов в крови, снижением «хорошего» холестерина ЛПВП, увеличением количества мелких, более плотных и атерогенных частиц ЛПНП [43, 46].
Если раньше мы свято верили, что враг наших сосудов номер один – это жиры и холестерин, то современные исследователи понимают, что одна из главных причин формирования атеросклеротических бляшек в сосудах, развития болезней сердца – это постоянно высокий инсулин. Высокий инсулин вызывает повышение кровяного давления, потому что он повышает уровень альдостерона, гормона, который сигналит почкам удерживать натрий в организме. А там, где натрий, там и вода. Организм задерживает воду, возникают не только отеки, но и повышается объем крови, и соответственно повышается кровяное давление (но это далеко не повод ограничивать соль, нужно всего лишь вернуть инсулин в норму). Более того, инсулин вызывает утолщение сосудочной стенки. Инсулин – это анаболический гормон, он заставляет наши ткани расти, и поэтому растут и уплотняются клетки эпителия сосудов. Если кровеносный сосуд становится более жестким, не расширяется, когда это необходимо, это тоже вызывает повышение давления. Обычно инсулин вызывает синтез оксида азота в эндотелии, расслабляя стенки сосудов. Но в условиях гиперинсулинемии, когда клетки «не слышат» сигналы инсулина, они не могут расслабиться, и это также повышает кровяное давление. Подобно толстому шлангу с большим напором воды, сосуды теряют способность расширяться, повреждаются, и, чтобы их «починить», организм бросает своих «спасателей» – частицы ЛПНП, которые содержат холестерин и антиоксиданты [43]. Точно так же, как мы не обвиняем в поджоге пожарных, оказавшихся в месте возгорания, мы не можем винить холестерин, который выступает в роли помощника, несмотря на то что его действительно находят в атеросклеротических бляшках.
3. Гиперинсулинемия способствует пролиферации онкообразований (рака молочной железы, яичников, толстого кишечника, мочевого пузыря, поджелудочной и печени), повышая уровень инсулиноподобного фактора роста-1 (IGF-1) и свободных радикалов, повреждающих ДНК, а также замедляющих апоптоз [43, 46]. Высокий уровень глюкозы в крови снабжает раковые клетки энергией.
4. Гиперинсулинемия способствует развитию нейродегенеративных заболеваний (болезнь Альцгеймера, деменция, ретинопатия, периферическая нейропатия, энцефалопатия, аутизм) за счет повышения уровня воспаления [43, 46].
5. Гиперинсулинемия вызывает многочисленные проблемы с эндокринной системой, нарушая регуляцию сигналов гормонов голода и насыщения, приводя к перееданию и ожирению и замедляя липолиз (высвобождение жира из жировой ткани). Чем «проще» углеводы, которые вы съели, тем быстрее поднимется глюкоза в крови, а за ней и инсулин. Инсулин «растолкает» глюкозу по периферии, но может переусердствовать, и она снизится ниже физиологической нормы. Отсюда возникает сильный голод – организму надо во что бы то ни стало восстановить уровень глюкозы, а значит, он начинает требовать быструю энергию, чтобы поскорее ее восполнить, а самая быстрая энергия – это углеводы. Это и есть гипогликемия. Именно она провоцирует тот самый сильный и «злой» голод, слабость, неспособность сосредоточиться и желание съесть что-нибудь сладкое буквально через 2–3 часа после приема пищи. Навязчивые мысли о еде и необходимость перекусывать постоянно – это яркая манифестация гиперинсулинемии [43, 46].
6. Гиперинсулинемия приводит к заболеваниям печени (неалкогольная жировая и другие болезни печени) и почек (диабетическая нефропатия) [43, 46].
7. Гиперинсулинемия вызывает проблемы с кожей (сухая кожа, трещины, акне, псориаз, экзема и так далее) [43, 46].
8. Гиперинсулинемия вызывает остеопороз [43, 46].
Чтобы вернуть инсулин в норму, необходимо изменить питание и образ жизни. Этого можно достичь и без кетоза. Но именно кетоны, как мы увидим далее, имеют множество полезных свойств, которые помогут сбросить лишний вес без голода, а также снизить уровень системного воспаления, присущего современным хроническим заболеваниям.
Хроническое воспаление
Сам по себе воспалительный процесс жизненно необходим для защиты от ран и инфекций. Но помимо острого воспаления, которое длится недолго и быстро проходит, существует и хроническое (или системное) воспаление – процесс, который, как и повышение инсулина, может протекать незамеченным годами и десятилетиями. И оно часто сопровождает уже знакомый нам метаболический синдром [47].
Хроническое воспаление естественным образом развивается с возрастом, но его могут значительно ускорить неправильное питание и образ жизни. Современные ученые называют этот феномен «inflammaging», соединив два английских слова «inflammation» (воспаление) и «aging» (старение).
Это состояние, характеризующееся повышенным уровнем маркеров воспаления в крови, несет в себе высокую восприимчивость к хроническим заболеваниям и разным их последствиям: хроническая болезнь почек, сахарный диабет второго типа, онкология, депрессия, деменция, саркопения, инвалидность, хроническая усталость.
Воспаление, так же, как и гиперинсулинемия, относится к факторам риска сердечно-сосудистых заболеваний (ССЗ), и клинические испытания показывают, что эта связь – причинная.
Как снизить хроническое воспаление?
Для этого необходимо восстановить работу митохондрий и не мешать им работать, как это было задумано природой.
Митохондрии – это маленькие «фабрики энергии» в наших клетках. Именно здесь происходит превращение того, что мы усвоили, в энергию. Если митохондрии не работают оптимально, это влияет на все: каждое сокращение мышц, каждое биение вашего сердца, работу пищеварительного тракта, детоксикацию и процессы удаления устаревших клеточных структур. Если же они работают оптимально, мы живем дольше, болеем меньше, а восстановление после травм и инфекций происходит быстрее.
Митохондрии чрезвычайно чувствительны к свободным радикалам, которые сами же и вырабатывают. В здоровой клетке эти свободные радикалы включают и выключают определенные процессы, и это совершенно нормально. Но есть факторы, приводящие к чрезмерной выработке свободных радикалов и повреждению митохондрий и ДНК. Это называется окислительным стрессом [48]. Хроническое воспаление «ломает» наши митохондрии, повреждая их мембраны и мембрану самой клетки, а также снижает уровень фермента NAD+, помогающего клеткам производить энергию. Это называется митохондриальной дисфункцией [49]. Как следствие, мы больше устаем, нам не хватает энергии. Развиваются все уже знакомые нам перечисленные выше болезни старения.

Большое количество свободных радикалов также изменяют сигналы гормона инсулина. Клетка перестает «слышать», то есть реагировать на инсулин. Это подтверждается и в лаборатории: люди с нарушенной чувствительностью к инсулину действительно имеют более высокие уровни маркеров окислительного стресса, чем здоровые люди. Многие лекарственные препараты, использующиеся для его подавления, имеют серьезные побочные эффекты.
Есть многие независимые от питания факторы, способные вызвать хроническое воспаление (ХВ):
• Слишком частые и интенсивные тренировки при недостаточном восстановлении между ними. То, что в простонародье называется «перетрен».
• Нестероидные антивоспалительные препараты (аспирин, ибупрофен).
• Ожирение (жировые клетки сами по себе выделяют провоспалительные цитокины).
• Хронические инфекции (например, периодонтит) и паразиты.
• Токсины окружающей среды.
• Нарушение режима сна.
• Хронический стресс.
• Курение и алкоголь.
Но всего лишь изменив питание и убрав вызывающие воспаление продукты, можно легко держать его под контролем без побочных эффектов и затрат, связанных с приемом лекарств.
Дело в том, что уже знакомая нам гиперинсулинемия тесно взаимосвязана с ХВ. Гиперинсулинемия его вызывает, но и само ХВ может привести к гиперинсулинемии – два сапога пара.
Помимо высокого инсулина, потребление масел, содержащих провоспалительные омега-6 жиры (в основном масла, выжатые из семян, типа подсолнечного, кукурузного, соевого и так далее), тоже вызывает хроническое воспаление, особенно когда нам не хватает противовоспалительных омега-3 жиров [50].
Совмещая эти масла с простыми углеводами, мы активируем NLRP3 инфламмасому [49]. К этой интересной штуке мы вернемся позже, когда будем говорить о пользе кетоза, а пока что постарайтесь запомнить этот термин.
Мы в силах значительно снизить маркеры хронического воспаления, всего лишь убрав из своего рациона продукты, вызывающие митохондриальную дисфункцию, то есть рафинированные углеводы и рафинированные омега-6 жиры, и помогая нашему организму вырабатывать больше внутриклеточных антиоксидантов. Кетоны, как мы вскоре увидим, помогут нам значительно снизить уровень воспаления [50.1].
Некоторые ученые видят хроническое воспаление как горящий фитиль, соединенный с углеводной бомбой. Сами по себе углеводы, особенно если они сложные, возможно, и не причинят проблем, главное, чтобы они использовались, а не откладывались в жир. Однако хроническое воспаление вместе с нарушением углеводного обмена запускает необратимый процесс как старения, так и развития хронических заболеваний.
Медицина не справляется с хроническими заболеваниями
В 70-х годах прошлого столетия нам внушили, что причина болезней сердечно-сосудистой системы – повышенный холестерин, а одна из причин ожирения – жиры. Именно поэтому в течение многих десятилетий нам рекомендовали и по сей день рекомендуют есть поменьше насыщенных жиров и жирной животной пищи, содержащей холестерин [51].
Что будет, если ограничить жир? Перед нами предстанет диета с большим количеством углеводов. Существует три главных макронутриента: белки, жиры и углеводы. Убирая жир, невозможно значительно увеличить норму белка, ведь нас одновременно с жирами пугают и вредом от избытка белка. Поэтому, ограничивая жиры, не стоит удивляться, что на их место встают углеводы, ведь больше ничего не остается! При соблюдении ограничений по жирам (текущие рекомендации: до 30 %) и белку (до 15 %) углеводов в рационе может быть от 55 % и выше!
Но углеводы, как и жиры, бывают разные. Если питаться исключительно правильно приготовленными крупами и некоторыми бобовыми, овощами, ягодами и несладкими фруктами, а также если человек в целом молод, здоров и физически активен, то никакого урона организму эти углеводы не причинят.
Однако человеку с метаболическим синдромом даже эти «полезные» углеводы (цельное зерно, бобовые, фрукты), которые вы часто встречаете в рекомендациях по питанию, лучше исключить, чтобы как можно быстрее вернуть инсулин в норму.
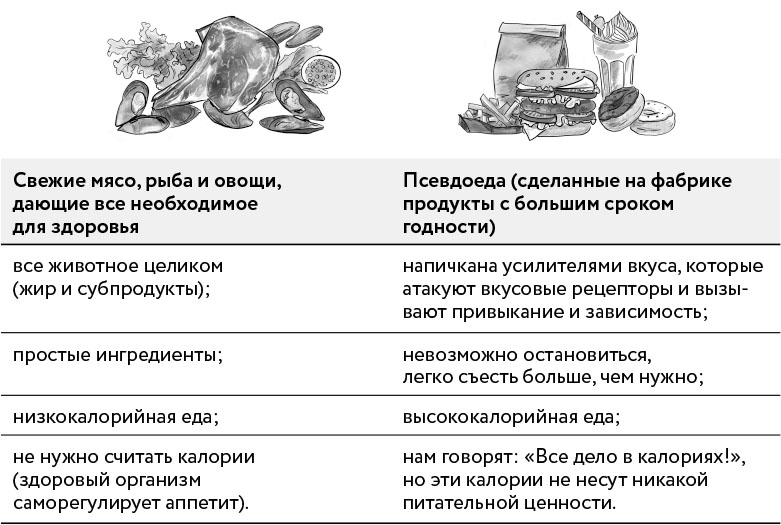
Еще более важно полностью исключить абсолютно все переработанные, то есть сделанные на фабрике продукты, но о важности цельных продуктов и нутритивной плотности рациона мы поговорим чуть позже.
А все потому, что у человека с гиперинсулинемией практически все углеводы, за исключением зеленых овощей и некоторых ягод и орехов, но особенно простые, рафинированные углеводы, зерно (даже цельное), бобовые и фрукты будут вызывать значительный скачок глюкозы и, следовательно, инсулина.
Как и углеводы, белок и жир также влияют на повышение инсулина.
На белок, если его есть ровно столько, сколько необходимо, вырабатывается гораздо меньше инсулина. А на жир инсулин практически не вырабатывается.

Все углеводы, простые и сложные, быстрые и медленные, в итоге всегда превращаются в глюкозу. Дело просто в скорости. Но на типичном для среднего обывателя 5–6-разовом высокоуглеводном питании глюкоза будет поступать постоянно, независимо от качества съеденных углеводов. Следовательно, инсулин будет высоким практически круглосуточно, и чем «проще» углеводы, тем хуже.
Инсулин, как мы упоминали, это гормон, отвечающий за распределение энергии: формирование запасов углеводов или, когда они переполнены, жира в нашем организме. У метаболически нездорового, мало двигающегося человека, в рационе которого подчас до 75 % углеводов, запасы гликогена переполнены постоянно. Любой избыток уходит в жировые депо.
Важно сказать и о том, что роль клетчатки, присутствующей в рекомендуемых нам цельнозерновых продуктах и фруктах, заметно преувеличена. Поскольку клетчатка не усваивается, она немного замедляет усвоение углеводов, но не настолько, чтобы иметь большое значение. Сравните, к примеру, белый и бурый рис. На 100 г в буром 25,6 г углеводов и 1,6 г клетчатки; в белом – 28,2 г углеводов и 0,3 г клетчатки.
Единственный способ сжигать подкожные жировые запасы в таком режиме – это постоянное ограничение (дефицит) калорий и повышение физической активности. А единственное время, когда мы не потребляем пищу и инсулин может немного снизиться для того, чтобы активировать жиросжигание, – это сон. Согласитесь – не очень большое «окно».
Длительный и постоянный дефицит калорий способен привести к замедлению метаболизма, который впоследствии приведет к еще большему набору веса, если человек поднимет калораж даже до предыдущего уровня. Человеку со значительным лишним весом будет сложно и порой даже опасно активно заниматься спортом, поэтому гораздо более оптимально и логично изменение питания в сторону снижения углеводов, а следовательно, и инсулина, прогулки и умеренные физические упражнения и только потом, когда вес начнет снижаться и появится больше энергии, активный фитнесс.
Врачи прошлого умели использовать низкоуглеводную диету для лечения диабета второго типа задолго до изобретения инсулина и метформина в 1922 году, потому что понимали: для решения проблемы нужно убрать причину – углеводы: сахар, бобовые, злаки и крахмалистые овощи.
Лечение этого заболевания было несложным и эффективным, но сегодня нам говорят о том, что это хроническое и прогрессирующее заболевание, которое не только невозможно вылечить, но и неизменно приводит к использованию лекарств. При этом нас предупреждают ни в коем случае не исключать углеводы из рациона. Эти рекомендации широко распространены, но не имеют доказательной базы. Безусловно, прописать пациенту лекарство гораздо легче, чем объяснить, как изменить питание.
Хорошие новости заключаются в том, что сейчас, когда пандемия метаболического синдрома и диабета второго типа неуклонно растет, медицина вспоминает про кето. Ведущие клиники и врачи США и других стран уже используют его в своей практике для лечения гиперинсулинемии и многих связанных с ней хронических заболеваний.
Как кетоз может помочь?
Как мы уже говорили, кетоны – это производные окисления жирных кислот, использующиеся организмом для синтеза энергии точно так же, как и глюкоза.
До начала XXI века научное и медицинское сообщество воспринимало кетоны как совершенно ненужный и даже опасный «мусор» метаболизма. Но все сильно изменилось за последние 20 лет, когда ученые начали активно изучать их свойства. Они обнаружили, что кетоны – это не только источники энергии, но и важные сигнальные молекулы, то есть они играют множество важных ролей в организме [52, 53, 54].
Напомним, что состояние, когда постоянно происходит синтез кетонов (кетогенез) и организм активно их использует для получения энергии, называется кетозом.
Есть несколько способов активировать кетоз:
• поголодать более суток;
• интенсивно потренироваться, но не восполнять потраченную энергию углеводами;
• питаться так, чтобы держать уровень инсулина постоянно низким, то есть ограничивать углеводы.
Кетоз активируется и поддерживается в условиях низкого количества углеводов, умеренного количества белка и высокого процента жира.
Существует три вида кетонов:
• ацетоацетат (ацетоуксусная кислота);
• β-гидроксибутират (бета-гидроксимасляная кислота), далее БОМК;
• ацетон.
В кетозе жир, поступающий с пищей или из собственных запасов подкожного жира, расщепляется до ацетоацетата. Ацетоацетат превращается в ацетон или БОМК. БОМК, ацетоацетат и жирные кислоты становятся основным источником энергии для мозга и сердца, а мы перестаем зависеть от постоянных углеводных «подзаправок». Когда это происходит, мы говорим, что человек жиро- или кетоадаптировался.
Синтез энергии в кетозе происходит в уже знакомых нам клеточных «энергостанциях» – митохондриях. Чем дольше мы находимся в кетозе, тем больше появляется митохондрий в клетках и тем лучше они работают. Это благотворно влияет на здоровье и самочувствие, ведь снижаются воспалительные процессы и генерируется большее количество энергии.
В кетозе митохондрии синтезируют до 95 % энергии для всего организма, в том числе и для мозга. Но некоторые клетки и органы, например эритроциты, сетчатка глаза и сама печень, не могут напрямую потреблять кетоны как энергию. И поэтому природа придумала процесс под названием глюконеогенез (буквально: сахар + новый + производство) – то есть синтез глюкозы из неглюкозных источников. Именно поэтому мы можем прекрасно обойтись без углеводов в кетозе – наш организм вполне способен синтезировать собственную глюкозу из белка и жира! Глюкоза, вырабатываемая в печени, поступает в органы, неспособные использовать кетоны, преимущественно в мозг. В кетозе мозг потребляет до 25 % глюкозы, остальную же энергию поставляют кетоны.
Углеводы – это относительно «грязное» топливо. Глюкоза расщепляется быстро, и для этого не всегда нужны митохондрии. Но быстрее – это не значит лучше. При распаде хронического избытка глюкозы в условиях митохондриальной дисфункции (и особенно при низкой физической активности) образуется много свободных радикалов, повышающих воспалительные процессы и повреждающих митохондриальную ДНК. Кетоны же – более мощное и экономичное топливо.
Представьте себе: вы развели костер исключительно на мелких палочках, щепках, древесной стружке и бумаге. Все это, конечно, будет отлично гореть, но вам придется постоянно подкладывать в огонь новые щепки и бумажки, и он будет то быстро угасать, то снова стремительно разгораться. Такой костер будет больше дымить.
Примерно так же горят углеводы. А если в костер положить парочку-тройку хороших бревен? Такой огонь будет дымить меньше, а гореть – долго и ровно. Вам не придется часто подбрасывать новые поленья. Именно так горят жиры [55].
Мы упомянули, что кетоны – это не просто источники энергии, а мощные сигнальные молекулы. Они подают сигналы, которые включают различные гены и запускают важные процессы в организме. Какие это процессы?
Кетоз снижает уровень хронического воспаления
Поскольку хроническое воспаление – независимый фактор риска для развития сердечно-сосудистых заболеваний, кетоз благоприятно влияет на здоровье сердца, сосудов и защищает от атеросклероза [52, 54, 56].
Помимо того, что на кето исключается большинство продуктов, вызывающих воспаление (рафинированные продукты, сахар и богатые омега-6 масла), сами кетоны напрямую влияют на снижение хронического воспаления благодаря блокировке той самой NLRP3 инфламмасомы, активирующей хроническое воспаление [57, 58]. Таким образом кетоны снижают уровень окислительного стресса, подавляя выработку свободных радикалов[5]