Часть I. Ингредиенты жизни
Глава 1. ДНК: код и спираль
В Национальной портретной галерее в Лондоне висит бежевая пластинка агаризованной питательной среды, поросшей бактериальными колониями1. В этих бактериях содержатся копии ДНК нобелевского лауреата Джона Салстона[5]. И хотя друзья Салстона, вероятно, не уловили бы здесь портретного сходства с моделью, художник Марк Куинн отмечает, что именно эта работа – «самый реалистичный портрет в портретной галерее», поскольку «содержит подлинные инструкции, которые привели к созданию Джона»2.
Сегодня даже малым детям объясняют, что ДНК каким-то образом делает вас вами, определяя цвет глаз, форму носа, вашу любовь к кориандру и многое другое. Мы привыкли к мысли, что в ДНК закодированы инструкции, которые управляют нами. Но что же означает это слово – «закодированы»?

Наше биофизическое исследование структур и механизмов жизни начинается с ДНК – молекулы знакомой, даже культовой, но абстрактной во многих встречаемых нами описаниях. На протяжении нескольких глав мы будем изучать, как инструкции прописываются в ДНК, рассматривая белки, гены и сети взаимосвязей между ними. За последние десятилетия представления ученых о том, как из этих компонентов составляются и сами сообщения, и инструменты для чтения сообщений, сильно расширились, и мы продолжаем, образно говоря, распутывать хитросплетения ДНК. Сравнительно недавно удалось разработать головокружительные способы вмешательства в закодированную в ней информацию, правда, исходы таких вмешательств мы в полной мере еще не представляем (см. часть III). В этой главе мы сосредоточимся на самой ДНК, что сразу же позволит прочертить связи между биологией и физикой, а также между наукой и технологиями.
ДНК – это не просто сборник абстрактных инструкций, а оформленное и структурированное вещество, физические свойства которого тесно связаны с его функциями. Что же представляет собой это вещество? Твердое оно или жидкое, жесткое или гибкое, плотно уложенное или рыхло? ДНК многогранна, и можно фокусироваться на разных ее аспектах в зависимости от того, что именно нас интересует. Давайте посмотрим на ДНК с четырех ракурсов.
1. ДНК – это бесцветная слизь. Мы можем подержать ДНК в руках и рассмотреть невооруженным глазом. Это несложно: с помощью блендера и простейших бытовых химикатов мы можем извлечь ДНК, скажем, из клубники или зеленого горошка. Рецепт примерно таков: измельчите фрукты или овощи блендером – так вы оторвете их клетки друг от друга. Добавьте в полученную массу моющее средство, чтобы растворить клеточные мембраны. Капните немного приправы для размягчения мяса или ананасового сока – там содержатся ферменты, расщепляющие белки. Теперь ДНК – единственный клеточный компонент, оставшийся невредимым. Добавьте медицинский спирт, который растворит фрагменты белка, но ДНК не тронет. ДНК соберется в длинные нити, которые можно вытянуть зубочисткой, – так мы получим мутно-белый волокнистый сгусток. Это и есть ДНК. Выглядит она так себе. Однажды извлечение ДНК на практикуме даже довело меня до слез. Дело, однако, было в том, что я совершил ужасную ошибку, выбрав в качестве исходного сырья для опыта лук – субстанцию удобно бесцветную, но страшно режущую глаз.

2. ДНК – это закодированное сообщение. На другом полюсе осязаемости находится ДНК в образе абстрактного, закодированного четырьмя символами сообщения. Эти символы принято обозначать буквами – A, T, Ц, Г, – но с нашей задачей справятся и четыре разноцветных квадратика. Та или иная последовательность символов кодирует информацию о том, как вашим клеткам строить то, что им необходимо строить, и делать то, что им необходимо делать. Сколько же информации способна вместить ДНК? Давайте сравним этот объем с объемом цифровой информации, хранящейся в переносном музыкальном плеере. Сегодня мы привыкли к «битам» и «байтам» – единицам информации. Бит (от англ. binary digit, двоичная цифра) – это любой сигнал, который может принимать лишь два значения: да или нет, 0 или 1, север или юг у магнита. Флешка емкостью 1 гигабайт содержит около 8 миллиардов бит информации: «гига» значит «миллиард», а байт состоит из восьми бит. Ее содержимое можно записать как определенную последовательность нулей и единиц (…01110100110010100011011101000011011100011010011…). А сколько же бит в последовательности ДНК каждого человека? Наша ДНК состоит из 3 миллиардов символов, то есть из 3 миллиардов A, T, Ц и Г. Чтобы перевести каждый символ в двоичный код, мы могли бы составить словарь, такой например:
00 = A
01 = T
10 = Ц
11 = Г
Последовательность ATTГЦ соответствовала бы 0001011110. Следовательно, в нашем геноме, состоящем из 3 миллиардов символов, содержится 6 миллиардов бит информации – это меньше гигабайта и, вероятно, заняло бы лишь малую часть памяти телефона, лежащего у вас в кармане. И вот загадка: при таком заметном дефиците информации во мне я кажусь гораздо более сложным, чем мой телефон! На страницах этой книги мы часто будем сталкиваться с концепцией сложности. Пока же нас интересует более насущный вопрос: как эта абстрактная картина с кодами и информацией соотносится с изображенным выше волокнистым сгустком?

3. ДНК – это молекула. Как и все молекулы, ДНК состоит из атомов – в ее случае из атомов углерода, водорода, кислорода, азота и фосфора, удерживаемых химическими связями. Четырьмя символами кода, упомянутыми выше, обозначают четыре специфических композиции атомов, называемые нуклеотидами (нуклеозидфосфатами)[6]. Они сшиты друг с другом в длинную цепь – молекулу ДНК. На рисунке ниже кружочками показаны все атомы аденозинмонофосфата (А), черными линиями обозначены химические связи. (Чтобы не перегружать рисунок, я решил пренебречь слишком уж многочисленными атомами водорода.) Ниже этой структуры я изобразил атомы четырехнуклеотидной последовательности AЦTГ, а многоточиями обозначил места, где этот фрагмент присоединялся бы к соседним нуклеотидам, входи он в состав более длинной нити. Определения последовательности нуклеотидов в цепи вполне достаточно, чтобы идентифицировать молекулу ДНК: сокращение AЦTГ, например, в точности соответствует структуре из атомов, которую я нарисовал, и не может относиться ни к какому другому набору атомов.

4. ДНК – это двойная спираль. Взаимодействия атомов определяют строение молекулы, а строение молекулы обусловливает ее функцию. Любой из четырех нуклеотидов – A, T, Ц, Г – может быть связан с любым другим для формирования одной нити ДНК. Но нуклеотиды также взаимодействуют, хоть и слабее, между нитями, причем весьма характерным образом: A связывается исключительно с T, а Ц – с Г. (Мы говорим, что нуклеотиды в этих парах комплементарны друг другу.) Одна нить ДНК – например, AГЦЦTATГA – связывается со своей комплементарной нитью TЦГГATAЦT[7]. На рисунке ниже показаны атомы ДНК, сформированной из нити AЦTГ и комплементарной ей TГAЦ; тонкими пунктирными перемычками там обозначены межнитевые связи[8]. Благодаря межатомным взаимодействиям нити ДНК, как плющ, обвивают друг друга, образуя двойную спираль. Этот рисунок вторит утрированному «портрету» двойной спирали, который мы видели бесчисленное множество раз: плавно изогнутые ленты и упорядоченные точки призваны чисто схематически передать куда более сложные расстановки атомов и связей, существующие в трехмерном пространстве.
Каноническая двойная спираль ДНК не только изящна, но и функциональна. Две комплементарные нити содержат избыточную информацию: если я сообщу вам последовательность нуклеотидов в одной нити, вы будете знать и последовательность в другой, поскольку каждый нуклеотид комплементарен своему партнеру. Эта избыточность показывает, как информация может переноситься при делении из одной клетки в две дочерние: ДНК «расстегивается», словно молния, и после этого синтезируется комплемент для каждой из исходных цепей, в результате чего из одной двойной спирали ДНК получаются две.
Структуру двухцепочечной ДНК в 1953 году вычислили Джеймс Уотсон и Фрэнсис Крик, опираясь на великолепные рентгеновские снимки Розалинд Франклин и ее студента Рэймонда Гослинга. (Это увлекательная история, полная гениальных прозрений и трагичных этических упущений, но она прекрасно рассказана в других источниках3.) Прежде никто не знал, как выглядят молекулы ДНК. Весомее прочих выглядела гипотеза Лайнуса Полинга, одного из ведущих исследователей химических связей: он предполагал, что ДНК формирует трехнитевое перекрученное волокно (тройную спираль). После открытия двойной спирали стало ясно, как структура ДНК обеспечивает передачу генетической информации: путем копирования комплементарных цепей. Однако другие следствия такого строения ДНК не столь очевидны, и мы до сих пор продолжаем изучать ее загадки.
В живых клетках, как и в стерильных лабораторных растворах, отдельные нити ДНК самопроизвольно закручиваются в двойную спираль, если содержат комплементарные последовательности нуклеотидов. Для этого не нужны ни внешние строительные леса, ни крепеж: ДНК содержит в себе механизм собственной организации, иллюстрируя принцип самосборки, снова и снова всплывающий при изучении жизни.

Каждый из описанных образов ДНК по-своему полезен и заостряет внимание на характеристиках, важных для исполнения этой молекулой разных ролей. Волокнистая слизь, извлекаемая из размолотых в пюре клеток, может, и неказиста на вид, но ни один из более эффектных способов применения ДНК – выделение из раковых клеток для изучения их геномов, сбор на местах преступлений для вычисления подозреваемых и так далее – не работал бы без учета материальной, физической природы ДНК. Образ абстрактной кодограммы сообщает нам, что информация, содержащаяся в ДНК, определяется последовательностью символов. Когда мы говорим об уникальности ДНК каждого человека, то подразумеваем, что ваша последовательность нуклеотидов, или цветных квадратиков, отличается от моей. (Правда, отличается она незначительно: более 99 % наших квадратиков совпадут.) Когда мы говорим, что знаем геном какого-то организма, то подразумеваем знание полной последовательности его символов. Это сообщает нам о многом, но, как мы увидим, все же оставляет массу неопределенности. Нам важно знать строение ДНК на атомном уровне – точную архитектуру ее атомов, а не только последовательность символов, – например, при разработке инструментов для разрезания и соединения нитей ДНК, о чем мы поговорим в контексте редактирования генома (см. часть III). Но чаще хватает и знания последовательности звеньев A, Ц, Г, T. Двойная спираль описывает, как ДНК располагается в пространстве. Размер, форма, жесткость и электрический заряд двухцепочечной ДНК определяют, как она упакована в клетках и как с нее считывается информация. Чтобы понять важность физической природы двухцепочечной ДНК, рассмотрим для начала процесс, который изменил биотехнологии, – полимеразную цепную реакцию.
Допустим, вы хотите создать точную копию интересующей вас ДНК. Для этого пришлось бы сначала разделить две нити двойной спирали, а затем создать нуклеотидные цепочки, комплементарные каждой из них. Фактически именно это и происходит при каждом делении клеток, когда специальные белки «расстегивают» двухцепочечную ДНК. Однако за пределами клеток мы можем применять другой подход, который позволяет нам реплицировать (размножать копированием) любые участки ДНК по нашему желанию: ничтожное количество ДНК мы преобразуем в бесчисленное множество идентичных копий, чтобы генетического материала хватило для проведения анализов или переноса в новые объекты. Крошечные количества нуклеотидных цепей можно, например, добыть на месте преступления, чтобы оценить их сходство с ДНК подозреваемых; или выделить из амниотической жидкости, чтобы проверить, нет ли у развивающегося плода генетических аномалий либо инфекций, которые можно выявить по нуклеиновым кислотам возбудителей; или извлечь из опухоли, чтобы картировать в геноме мутации, указывающие на развитие рака; или, наконец, отобрать из организма нобелевского лауреата, чтобы реплицировать и по частям внедрить в бактерии, которые разрастутся в настоящий арт-объект. Искусственная репликация ДНК, как и естественная, требует разделения двойной спирали, а его, в свою очередь, обеспечивает такое физическое явление, как фазовый переход4.
Представьте, что нас интересует, как разделить не нити двойной спирали ДНК, а прочно связанные молекулы воды, из которых состоит кубик льда. Мы знаем ответ: лед надо нагреть. При температуре выше 0 °C лед расплавляется в жидкую воду, где каждая молекула пребывает в движении, лишь мимолетно связываясь с другими молекулами. Как правило, температура выступает злейшим врагом притяжения и порядка, и эта тема постоянно всплывает в физике. В случае с водой переход из твердого состояния в жидкое происходит резко, как только достигается температура плавления, равная 0 °C при нормальном атмосферном давлении. Даже если температура хотя бы на пару градусов ниже нуля, вода пребывает в твердом состоянии, если же на пару градусов выше – в жидком. Не у всех веществ, однако, этот переход столь же резок. Мед при нагревании не становится текучим только в момент достижения определенной температуры, а теряет вязкость постепенно.
Как мы помним, связи между нитями двойной спирали ДНК слабее, чем внутри нити. Это позволяет нам предположить, что можно разделять нуклеотидные цепочки нагреванием, не уничтожая их. И так оно и есть, но насколько постепенно происходит это преобразование? Иными словами, плавится ли ДНК? Ответ на этот вопрос важен, если мы хотим разделять нити для дальнейшей репликации. Если ДНК плавится (денатурирует в узком диапазоне температур, резко), то превышением температуры фазового перехода даже на несколько градусов мы точно добьемся полного разделения цепей (см. верхнюю половину рисунка). Если же ДНК не свойственен такой фазовый переход, то, скорее всего, часть молекулы останется неразделенной и ее невозможно будет скопировать (см. нижнюю половину рисунка).
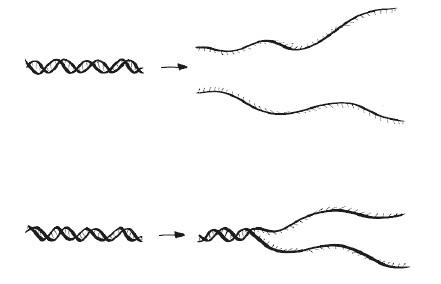
Во втором случае мы можем продолжать нагрев до тех пор, пока не разделятся все фрагменты ДНК, но, вероятно, на практике это потребует таких высоких температур, что сама ДНК и любые другие биологические молекулы окажутся поврежденными.
Как выясняется, цепи ДНК разделяются резко, то есть молекула действительно плавится. Если взять пробирку с ДНК и нагреть ее, молекулы останутся двухнитевыми до достижения определенной температуры плавления, а сразу после ее превышения распадутся на отдельные нити. Мы не просто можем измерить это в лаборатории, но и понимаем, почему так происходит. Выяснение природы фазовых переходов – переходов между твердым, жидким и газообразным состояниями, или между магнитной и немагнитной формами, или между любыми другими альтернативными структурами материалов – стало одним из величайших триумфов физики XX века. Плавление ДНК – это переход от порядка к беспорядку, в целом типичный для всех переходов, но имеющий свои особенности.
Все фазовые переходы отражают конфликт порядка и беспорядка. В основе порядка, как правило, лежит энергия, связанная с притяжением или выравниванием, а беспорядок определяется геометрией – тем, какими способами компоненты могут располагаться в пространстве. Повышение температуры многократно усиливает позиции беспорядка. При низкой температуре побеждает стремление к порядку, при высокой беспорядок берет верх. Так, в холоде молекулы воды выстраиваются в кристаллическую решетку льда, а когда теплеет, их положение в пространстве характеризуется типичной для жидкости хаотичностью. Утверждение, что плавление представляет собой резкий переход от одного состояния к другому, означает существование специфической температуры, разделяющей их, то есть четкой границы между фазами порядка и беспорядка.
Энергия упорядочения и разновидности беспорядка зависят от того, какие измерения может осваивать вещество. Последствия фазовых переходов драматичны, и в общем случае теория не предсказывает резкого перехода одномерных материалов из одной фазы в другую. Так, цепочка из молекул воды не должна расплавиться вдруг в какой-то точке температурной кривой: беспорядок возникнет уже при самой низкой из возможных температур и будет неуклонно усиливаться с ее повышением.
С приличной долей приближения можно сказать, что протяженная двухцепочечная ДНК одномерна – как идущие одна за другой ступеньки на приставной лестнице. Следовательно, ее резкое плавление, наблюдаемое в лаборатории, вроде бы противоречит ожиданиям. Однако, когда нити расцепляются, высвобожденная одноцепочечная ДНК изгибается и скручивается в трех измерениях (см. рисунок) под действием случайных сил, влияющих на все молекулы, которые мы обсудим в этой книге. Хотя движения нитей случайны, их последствия стабильны и предсказуемы (с подобным мы не раз еще столкнемся): благодаря конечной конфигурационной свободе полное их разделение происходит при фиксированной температуре перехода, как это свойственно трехмерным материалам. Располагая экспериментальными данными и теоретическим обоснованием, мы можем даже спрогнозировать температуру, при которой разделится та или иная молекула ДНК. Обычно температура перехода составляет около 95 °C, что чуть ниже температуры кипения воды, но точное значение сильно зависит от нуклеотидной последовательности.

Итак, мы можем разделить нити ДНК в пробирке, просто нагрев ее. Если мы хотим реплицировать эту ДНК, далее необходимо построить комплементарные последовательности к каждой из нитей. Для этого мы можем позаимствовать у природы инструмент, рутинно применяемый нашими клетками, – фермент ДНК-полимеразу. Однако при температуре плавления ДНК обычные белки превратятся в бесполезную резиноподобную массу наподобие вареного яичного белка (который в сухом остатке и состоит главным образом из белка). Биологам пришлось найти хитрый способ этого избежать: мы применяем ДНК-полимеразы из бактерий, живущих в горячих источниках, поскольку белки этих организмов в ходе эволюции приспособились исправно работать при высокой температуре. При этом важно, что для начала репликации нити ДНК любой полимеразе необходим хотя бы небольшой двухнитевой участок молекулы (см. рисунок ниже). Бактериологи обнаружили и очистили термостабильную полимеразу в 1976 году, и к началу 1980-х все ингредиенты оказались в сборе. В 1983 году рецепт, в котором сочетаются нуклеотиды, полимеразы, молекулы ДНК и температура, пришел в голову ученому Кэри Муллису, когда он ночью ехал вдоль Берегового хребта Калифорнии5. Вместе с рецептом пришло и осознание, что так открывается дорога к простой и почти безграничной репликации ДНК. Сегодня этот процесс называется полимеразной цепной реакцией, или ПЦР[9].

Чтобы провести ПЦР, первым делом мы вносим в деионизованную воду со специальным солевым раствором (буфером) все ингредиенты: небольшое количество ДНК, которую мы хотим реплицировать[10]; ДНК-полимеразу; отдельные нуклеотиды (A, Ц, Г и T) в большом количестве и праймеры – в достаточном. Праймеры, или затравки, представляют собой короткие одноцепочечные фрагменты ДНК (обычно не длиннее 30 нуклеотидов), комплементарные концам копируемого участка ДНК. Мелкие детальки, разбросанные по рисункам, – это праймеры (они подлиннее) и нуклеотиды (они покороче).
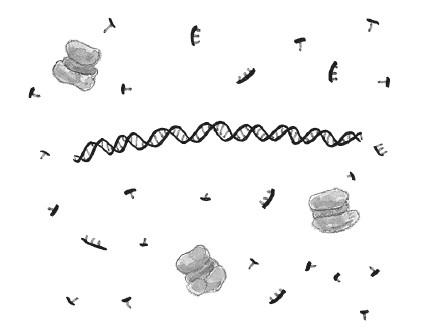
Далее мы повышаем температуру примерно до 95 °C, чтобы расплавить ДНК и из исходной двойной спирали получить две отдельные нити.

После этого мы понижаем температуру, чтобы праймеры связались с соответствующими концами однонитевых ДНК. Праймеров много, поэтому матричная однонитевая ДНК с гораздо большей вероятностью наткнется на праймер, чем на свою бывшую партнерскую нить: предсказуемая случайность работает на нас. Далее полимераза «садится» на ДНК-матрицу и наращивает конец праймера подходящими нуклеотидами, звено за звеном синтезируя комплементарную нить. После завершения процесса мы получаем две двойных спирали ДНК, созданные по шаблону одной исходной.

Затем мы повторяем цикл нагревания, охлаждения и синтеза, что дает нам уже 4 молекулы ДНК; в последующих циклах мы получим 8, 16, 32, 64… Соответственно, 10 удвоений даст нам 1024 молекулы, 20 – миллион, 30 (что вполне позволяют автоматизированные приборы для ПЦР – амплификаторы, или термоциклеры) – более миллиарда![11]
Следовательно, ничтожное количество ДНК мы можем превращать во множество идентичных молекул, тем самым как бы усиливая шепот до громкого хора реплик, который можно на любой вкус применять в медицинской диагностике, терапии и криминалистике. В живых организмах копирование ДНК происходит только в качестве элемента замысловатого репродуктивного танца, порождающего совершенно новую клетку или даже организм. Полимеразная цепная реакция позволяет копировать ДНК по нашему желанию. Рецепт ее прекрасен в своей простоте. Сам Муллис писал, что, узнав о его изобретении, молекулярные биологи «чуть ли не всегда первым делом произносили: `И почему же я до этого не додумался?'«Муллис отвечал на это так: «И никто на самом деле не знает почему; я уж точно не знаю. Однажды ночью эта мысль просто врезалась мне в голову».
Приручив репликацию ДНК, мы можем создавать достаточное количество копий для секвенирования генома – установления точного порядка нуклеотидов в нем с помощью техник, которые мы опишем в части III. Этот подход позволил нам картировать геномы человека и многих других организмов.
Поскольку для ПЦР нужны праймеры, которые создают необходимый для полимеразы короткий двухнитевой участок ДНК и прикрепляются только к комплементарной им нуклеотидной последовательности, у вас может возникнуть вопрос, не должны ли мы тогда заранее знать, какую последовательность амплифицируем. Нет, это не обязательно. Прежде всего для каких-то целей достаточно знать лишь часть генома организма, с ДНК которого мы работаем, и тогда можно конструировать праймеры, прикрепляющиеся именно к этой части. В большинстве же случаев мы можем нарезать неизвестную ДНК на фрагменты и встроить их в хорошо знакомую нам ДНК, например в специальные элементы генома легко выращиваемых бактерий[12]. Для этого мы используем встречающиеся в природе белки, которые сшивают нити ДНК. В таком варианте праймеры, комплементарные известной ДНК, направят ДНК-полимеразу на неизвестные части. Именно так «прочитали», например, выделенный из древних останков геном шерстистого мамонта, вымершего несколько тысяч лет назад.
Полимеразная цепная реакция стала неотъемлемой частью решения почти всех задач, связанных с ДНК. При этом сама она обеспечивается совмещением биологических редкостей (вроде термофильных микроорганизмов) с физическими универсалиями (вроде такого фазового перехода, как плавление), хотя по отдельности они могут казаться слабо связанными с практическими задачами. Кроме того, ПЦР наглядно подкрепляет тезис, ключевой для многих современных технологий и природных процессов: ДНК – это не просто код, не какая-то абстракция, а вполне осязаемый физический объект. Руководствуясь прежде всего принципами самосборки и прогнозируемой случайности, мы можем обосновывать и даже изобретать методы работы с этой важнейшей молекулой.
Мы зададимся еще множеством вопросов о ДНК: сколько ее у нас? как она хранится, упорядочивается и декодируется в наших клетках? как мы можем изменять свой геном (или геном нашего будущего ребенка)? Эти вопросы связывают друг с другом физические свойства и биологические функции. Но чтобы ответить на них, нам нужно познакомиться с другим ключевым игроком на клеточной арене – белком. В следующей главе мы узнаем, что такое белки и как они взаимодействуют с ДНК.
Глава 2. Белки: молекулярное оригами
В основе почти любого действия или события в вашем организме лежит белок. Белки в красных кровяных тельцах обратимо связывают кислород из воздуха, которым вы дышите. Одни белки тянут за собой другие, обеспечивая сокращение ваших мышц. Белки вытягивают и втягивают выпячивания, с помощью которых клетки иммунной системы протискиваются сквозь ваши ткани. Одни белки в ваших глазах улавливают свет и порождают электрические импульсы, а другие открывают и закрывают шлюзы, направляя эти импульсы в ваш мозг. Множество разных белков содержится не только в клетках, но и за их пределами, придавая, например, прочность и эластичность вашим тканям. Но что же такое белки?
Как и ДНК, белок – это молекула, состоящая из выстроенных в цепь простых единиц. В ДНК простейшим звеном может выступать любой из четырех нуклеотидов, а в белке – любая из 20 аминокислот. В каком бы порядке ни располагались нуклеотиды в цепи, двухцепочечная ДНК всегда укладывается в двойную спираль. Структура белков, напротив, определяется их аминокислотной последовательностью. Каждый белок имеет характерное лишь для него расположение аминокислот, а следовательно, и отличную от других трехмерную форму. Схемы и инструменты для постройки белка закодированы в нем же. В белках, пожалуй, ярче всего проявляется принцип самосборки, подразумевающий, что природа кодирует инструкции по организации вещества в самом веществе, затем они активируются и выполняются универсальными физическими силами. Самосборка характерна не только для живых организмов – насыпаемый песок, например, собирается в конусы, наклоненные под определенными углами, а мыльные пузыри оформляются в сферы, – но в биологии она вездесуща. Изучая белки, мы увидим, как силы порождают формы, как этот процесс увенчивается успехом и все же иногда с треском проваливается и как тяжело компьютерам даются геометрические расчеты, с которыми молекулы справляются за микросекунды.
Аминокислотная цепь в воде изгибается, перекручивается и складывается в специфическую форму. Чаще всего в белках встречаются два варианта вторичной структуры: спирали и листы (на рисунке – слева и справа соответственно).

Я не стал рисовать все атомы в этих структурах, а ограничился лишь несколькими показательными точками и связями между ними. Спиральная и листовая структуры в белковых молекулах настолько распространены, что мы часто изображаем стилизованные формы – плавную спираль диаметром около нанометра (одной миллиардной доли метра) и лист (или слегка складчатый слой) из нескольких тяжей шириной примерно треть нанометра.
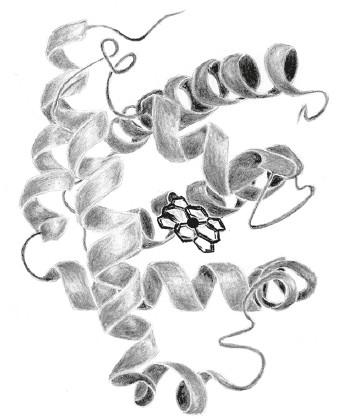
Раньше всего, в 1958 году, была открыта трехмерная структура белка миоглобина, который переносит кислород в мышцах. Как и в случае ДНК и многих других молекул, это стало возможно благодаря математическому анализу дифракционной картины, полученной в результате облучения вещества рентгеновскими лучами. Структурой миоглобина занималась в Кембриджском университете группа Джона Кендрю. Для проведения рентгенографии белки нужно перевести в твердое состояние, превратив в кристаллы. Но если кристаллы сахара, например, можно получить на любой кухне, то подтолкнуть белки к кристаллизации не так-то просто даже в современной лаборатории. Сотрудники Кендрю безуспешно экспериментировали с миоглобином морских свиней, пингвинов, морских котиков и других животных, пока не наткнулись на мясо кашалота, очень кстати припасенное в морозильной камере на Кембриджской станции низкотемпературных исследований. (Особенное внимание именно к этой группе животных объясняется тем, что мышцы морских обитателей, дышащих воздухом и погружающихся на большую глубину, содержат очень много миоглобина, который позволяет им запасать больше кислорода и реже всплывать на поверхность.) Белок кашалота формировал «поистине изумительные <…> гигантские кристаллы»1. Изучив их, Кендрю и его коллеги определили, что 153-аминокислотная цепь миоглобина складывается в структуру из восьми спиралей и нескольких неспиральных перемычек, прикрепленную к плоскому небелковому комплексному соединению, в котором атом железа связывается с кислородом (см. рисунок).

Пример белка, состоящего главным образом из листов, мы тоже можем найти в морском мире. Зеленый флуоресцентный белок, GFP, – это светоиспускающий белок, впервые обнаруженный в организме биолюминесцентной медузы. GFP представляет собой цепь из 238 аминокислот, сложенную в бочонок из листов шириной около трех нанометров, внутри которого находится фрагмент молекулы, отвечающий за испускание зеленого света (см. рисунок ниже2). Этот белок не остался простой океанической диковиной. Ученые научились внедрять GFP в бактерии, грибы, растения и даже животных, от плодовых мушек до рыбок данио-рерио, превратив его в своеобразный маяк, метку, позволяющую визуализировать нужные типы клеток и наблюдать, как они растут, движутся и делятся. Кроме того, GFP можно cшивать с интересующими белками, создавая так химерные молекулы-репортеры, за которыми легко следить: по свечению можно узнать, в какой части клетки они находятся, как ведут себя, когда клетки выполняют разные задачи, какие связи устанавливают с другими белками при создании более сложных структур[13]. Сегодня существует богатая палитра производных от GFP либо происходящих из кораллов флуоресцентных белков, испускающих свет всех цветов радуги и носящих названия от незамысловатых («красный флуоресцентный белок») до куда более выразительных («мандарин», «вишня», «слива» – целая серия фруктовых имен). Этот ансамбль лег в основу многоцветной визуализации биологических механизмов, сферы применения которой вышли далеко за пределы морской колыбели этих белков[14]3.
Трехмерная структура белка важна в первую очередь потому, что тесно связана с его химическими или физическими задачами. Так, у GFP бочонок защищает светоиспускающий механизм от гашения водой и растворенным в ней кислородом. Однако следующие примеры покажут взаимосвязь строения и функций белков еще нагляднее.
Тонкие мембраны разделяют клетку на отсеки и отгораживают ее внутреннее пространство от окружающей среды. Особые мембранные белки, часто формирующие структуры в виде бочонка или кольца, обеспечивают сквозной транспорт атомов и молекул. Один из классов таких транспортеров составляют ионные каналы, пропускающие те или иные ионы – заряженные атомы калия, натрия и хлора, например – внутрь или наружу клетки через центральную пору, которая может быть открыта или закрыта. Контролировать поток ионов критически важно. Скольжение вашего взгляда по этой странице и бег мыслей у вас в голове определяются электрическим напряжением мембран (мембранным потенциалом), которое возникает при перераспределении ионов через них. Многие токсины животных, включая змей и скорпионов, действуют именно на ионные каналы, блокируя в итоге нервную систему жертв. На рисунке ниже изображен калиевый канал в поперечном разрезе (подразумеваемая мембрана лежит в плоскости листа)4. Центральной точкой обозначен ион калия, движущийся к нам или от нас, то есть входящий в клетку или выходящий из нее. Канал этот состоит из четырех идентичных молекул белка, которые свободно связываются друг с другом, формируя трансмембранную пору.

Если каналы могут только открываться и закрываться, то другие белки способны на более замысловатые упражнения. На следующем рисунке я изобразил димер из двух молекул белка кинезина5. Как подсказывает его название, этот белок участвует в движении. Молекула кинезина представляет собой длинный стебель, соединенный гибким аминокислотным шарниром с основанием в виде луковицы. Спиральные стебли двух молекул переплетаются и верхними частями специфически прикрепляются к грузу, который необходимо переместить внутри клетки. Грузом могут быть, например, мембранные пузырьки с химическими веществами, которые синтезируются в теле нейрона, а ожидать высвобождения должны на его периферии. Сформированный комплекс моторного белка с грузом проходит по внутриклеточным «рельсам», микротрубочкам, причем проходит в прямом смысле: две округлые ножки по очереди прикрепляются к рельсам и открепляются от них, шаг за шагом приближаясь к пункту назначения[15]. (Эти ножки принято называть головками, а шагающее движение со сменой опережающей ноги – перехватывающим. Да-да, терминология не самая очевидная.) Рельсы тоже состоят из белков – на сей раз способных выстраиваться в жесткие трубочки, – и их трехмерная структура тоже позволяет им выполнять свою работу.

Строение белков влияет на их взаимодействие как друг с другом, так и с веществами иной природы – например, с ДНК. В следующих двух главах мы увидим, что многие белки прикрепляются к ДНК, чтобы руководить считыванием генетической информации. Эти ДНК-связывающие белки должны принимать форму, соответствующую изгибам двойной спирали ДНК. В таких белках часто встречаются спиральные мотивы, способные укладываться в бороздки ДНК. Для примера я изобразил гормон-чувствительную молекулу, называемую глюкокортикоидным рецептором6. (Эти белки работают в парах; широкими спиральными лентами я показал прилежащие к ДНК участки такой пары.) Когда к рецептору прицепляется гормон кортизол, его структура меняется, и только тогда он получает возможность связываться с ДНК и запускать последовательность событий, которая среди прочего подавляет воспалительный иммунный ответ[16]. Вероятно, вы знакомы с кортизолом, под названием «гидрокортизон» входящим в состав мазей, и извлекали пользу из его способности активировать рецепторы: у вас уменьшались покраснение, зуд и отечность от укусов насекомых и контакта с ядовитым плющом или другими раздражителями.

Как мы увидели, структура белка тесно связана с его функцией, однако свою конечную форму он приобретает не сразу. Каждый белок создается клеточными машинами, которые последовательно прикрепляют одну аминокислоту к другой, составляя из них цепочку, как из скрепок. Не существует никакого каркаса, который определял бы укладку такой цепочки, организуя ее в стопки листов, клубки спиралей или другие формы из почти бесконечного многообразия. Белок сам моделирует себя, укладываясь в пространстве должным образом: факторы, определяющие его структуру, зашифрованы прямо в его аминокислотной последовательности. Иными словами, белок осуществляет самосборку.
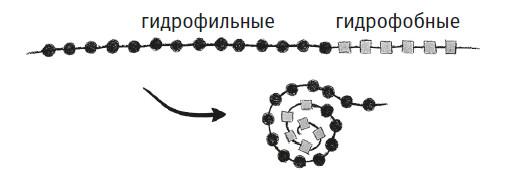
Каждая из 20 аминокислот обладает определенным набором физических характеристик. Одни аминокислоты заряжены положительно, другие – отрицательно, третьи нейтральны. Одни большие, другие маленькие. Какие-то из них гидрофобные (по сути, жирные) и предпочитают не смешиваться с водой, другие – гидрофильные и легко с ней смешиваются. Представьте белок, в котором подряд идут несколько положительно заряженных аминокислот, затем – цепочка нейтральных гидрофильных аминокислот, а после них – несколько отрицательно заряженных (см. рисунок). Разноименные заряды притягиваются, поэтому, предоставленный сам себе, белок укладывается так, что его противоположные концы сближаются.

Теперь представьте белок, состоящий из гидрофобных (квадратики) и гидрофильных (кружочки) аминокислот. Этот белок окружен водой (преобладающим компонентом внутриклеточной среды) и укладывается так, чтобы гидрофобные фрагменты прятались в центре кольца из любителей воды. Ради ясности я нарисовал эту схемку в двух измерениях. На самом же деле вам нужно представить почти сферическое ядро из гидрофобных аминокислот, окруженное оболочкой из гидрофильных.
В любом реальном белке происходит множество таких взаимодействий между аминокислотами, а также между аминокислотами и окружающей их водой, что порождает силы, вынуждающие белок принять определенную конформацию. Каждый белок синтезируется в клетке как цепочка аминокислот, и эта цепочка укладывается в оптимальную трехмерную форму. По-научному этот процесс называется фолдингом белка