1. Инфекционный ринотрахеит крупного рогатого скота
Инфекционный ринотрахеит – Rinotracheitis infectiosa bovum – (ИРТ, пузырьковая сыпь, инфекционный вульвовагинит, инфекционный некротический ринотрахеит, инфекционный ринит, “красный нос”, контагиозная бронхопневмония, инфекционный катар верхних дыхательных путей) – остро протекающая, контагиозная болезнь КРС, характеризующаяся преимущественно катарально-некротическими поражениями дыхательного тракта, лихорадкой, общим угнетением и конъюнктивитом, а также развитием пустулёзного вульвовагинита и, при попадании вируса в половые органы животного – абортами.
1.1. Историческая справка, классификация, номенклатура герпесвирусов
1. В медицине термин “герпес” (в переводе с греческого – ползать) известен со времён Гиппократа. В ветеринарии болезни, вызываемые герпесвирусами, тоже были известны намного раньше, чем природа этиологического агента. Эндрюс первым отнёс возбудителя болезни под названием “вирус инфекционного ринотрахеита крупного рогатого скота” (ИРТ КРС) к семейству герпесвирусов группы ДНК-содержащих вирусов. При этом он отметил, что данный вирус может вызывать также инфекционный пустулёзный вульвовагинит (ИПВ), или коитальную экзантему. Вначале на основании серологического родства считали, что возбудители ИРТ и ИПВ. абсолютно идентичны, но поздние результаты электрофоретических исследований показали, что эти вирусы отличаются друг от друга. Через несколько лет серологически идентичные вирусу ИПВ или родственные ему возбудители были выявлены как причина конъюнктивитов, абортов, энцефаломиелитов и маститов. Инфекционный характер болезни был установлен ещё в XIX веке, этиология была описана Рейзингером и Рейманом лишь в 1928 году – через 19 лет после вступления в силу закона об инфекционных болезнях скота (в 1909 году), в котором были унифицированы ветеринарно-полицейские мероприятия по борьбе с этим заболеванием.
2. В 50-х годах в США у крупного рогатого скота стали отмечать инфекционное заболевание верхних дыхательных путей (особенно на откормочных и крупных молочных фермах). Поначалу это заболевание носило самые различные названия – “красный нос”, инфекционный некротический ринотрахеит. Предложенное Мак Керчером название инфекционный ринотрахеит – сокращённо ИРТ КРС – было принято повсеместно.
В СССР заболевание впервые наблюдал в 1938 году Ф.М. Пономаренко и описал его как инфекционный катар дыхательных путей. В 1969 году вирус ИРТ был выделен Н.Н. Крюковым от больных телят с признаками поражения верхних дыхательных путей.
3. В 1954 году C.H. Andrews впервые составил номенклатуру вирусов семейства герпеса. В 1970 г. на X Международном конгрессе микробиологов были рассмотрены предложения о группировании известных в настоящее время вирусов семейства герпеса.
Классификация семейства герпесвирусов
♦ вирус простого герпеса (herpes simplex virus);
♦ вирус герпеса обезьян (вирус В) Старого Света;
♦ вирус герпеса обезьян мармозет (вирус Т);
♦ вирус герпеса обезьян церкопитекус;
♦ вирус герпеса обезьян патас;
♦ вирус герпеса обезьян саймири;
♦ вирус герпеса обезьян ателес;
♦ вирус герпеса кроликов (вирус 111);
♦ вирус псевдобешенства (вирус болезни Ауески);
♦ вирус инфекционного ринотрахеита крупного рогатого скота;
♦ вирус ветряной оспы – зостер (вирус V-Z);
♦ вирус ринопневмонии лошадей;
♦ вирус герпеса лошадей (LK и 2);
♦ вирус злокачественного катара рогатого скота;
♦ вирус бычьего язвенного мамиллита (virus Alterton);
♦ вирус ринотрахеита кошек;
♦ вирус герпеса собак;
♦ вирус лимфомы Баркитта (вирус Эпштейна-Барр);
♦ вирус болезни Марека;
♦ вирус ларинготрахеита птиц;
♦ вирус герпеса птиц;
♦ вирус карциномы лягушек (вирус Lucke);
♦ вирус лимфосаркомы Ксенопус;
♦ вирус герпеса змеи;
♦ цитомегаловирусы человека, животных (мышей и морских свинок);
♦ вирус ринита свиней;
♦ вирус легочного аденоматоза овец;
Возможные представители семейства герпеса: вирус уток и вирус мышей, герпесподобные агенты у моллюсков и грибов. Неклассифицированными остались герпесвирусы рыб.
Комитет под председательством Ройцмана в 1973 году предложил обозначить герпесвирусы крупного рогатого скота следующим образом:
♦ Herpesvirus bovis 1 – вирус инфекционного ринотрахеита крупного рогатого скота;
♦ Herpesvirus bovis 2 – вирус мамиллита крупного рогатого скота;
♦ Herpesvirus bovis 3 – вирус злокачественной катаральной лихорадки крупного рогатого скота; вирус африканской злокачественной катаральной лихорадки;
♦ Herpesvirus bovis 4 – герпесвирус лёгочного аденоматоза овец.
В 1977 году R.W. Jioness, D.N. Watson разделили вирусы герпеса позвоночных на 3 большие группы, в зависимости от типа клеток, вовлекаемых в инфекционный процесс, и персистенции у естественных хозяев, а также по их патогенному действию на филогенетически близкие организмы.
Вирусы первой группы формируют латентную инфекцию у взрослых организмов, но часто вызывают генерализованные заболевания у новорожденных и взрослых при иммунодефицитных состояниях. Большинство таких вирусов отнесено к цитомегаловирусам и включает возбудителей, вызывающих заболевания у людей, обезьян, свиней, лошадей и других позвоночных.
Вирусы второй группы, называемые лимфотропными герпесвирусами, характеризуются слабыми, транзиторными лимфопролиферативными заболеваниями у их естественных хозяев и персистируют в лимфоцитах. Однако, они нередко являются причиной тяжёлых смертельных лимфом и лейкозов, когда ими инфицируют родственные микроорганизмы и при наличии добавочных экзогенных, генетических и других факторов (например, смешанная инфекция). В свою очередь они подразделены на вирусы с тропизмом к В-клеткам (вирус Эпштейн-Барр, вирус герпеса обезьян патас) и вирусы с тропизмом к Т-клеткам, такие, как вирус герпеса обезьян саймири и ателес, вирус болезни Марека.
Вирусы третьей группы служат причиной кожных проявлений заболевания, а также поражают респираторный тракт естественных хозяев. Эти вирусы обычно персистируют в центральной нервной системе, поддерживая латентную инфекцию, нередко сопровождающуюся периодическими обострениями. Иногда они вызывают тяжелые энцефалиты. Типичными представителями этих вирусов являются вирус простого герпеса, вирус ринотрахеита крупного рогатого скота, вирус ветряной оспы – зостер.
Следует отметить, что современная классификация семейства герпесвирусов, основанная на этих данных, не завершена.
В настоящее время сформированы 3 подсемейства: Alphaherpesvirinae (l-герпесвирусы), Bethaherpesyirinae (В-герпесвирусы), Gammaherpesvirinae (g-герпесвирусы).
L-герпесвирусы – герпесвирус человека, герпесвирусы лошадей, свиней, кошек, собак, вирус инфекционного ринотрахеита крупного рогатого скота.
В-герпесвирусы – цитомегаловирусы обезьян, свиней, крыс, хомяков, мышей.
G-герпесвирусы – герпесвирусы обезьян (высших и низших), вирус болезни Марека, вирусы кроликов, индеек.
1.2. Возбудитель инфекционного ринотрахеита крупного рогатого скота
Используя метод негативного контрастирования препаратов, было обнаружено, что капсид обладает кубическим типом симметрии и является двадцатигранником (икосаэдром). Вирион состоит из капсида диаметром 120–150 нм, окруженный липидсодержащей оболочкой. Плавучая плотность капсида составляет 1,305 г/мл. Он окружает ядро вируса из ДНК, которая намотана на белковую шпульку. В одном вирионе может быть около 33 различных структурных белков с молекулярной массой до 290000. Геном вируса состоит из двуспиральной ДНК с молекулярной массой 92-102×106 дальтон. Содержание гуанина и цитозина в ДНК колеблется в пределах от 33 до 74 %. Капсомеры, составляющие капсид – полые образования, пентагексагоналъные в поперечном сечении. Капсид содержит 162 полых капсомера.
Размножение вируса начинается в ядре инфицированной клетки и дополняется образованием гликопротеидно-липидной мембраны при прохождении вируса через внутреннюю пластину ядерной мембраны в эндоплазматический ретикулум клетки. Характерными признаками являются окаймление хроматина и ядерные тельца включения, эти образования рассматриваются некоторыми исследователями как место собирания вируса. В течение 10–12 часов после заражения в клетках, не удаётся обнаружить каких либо характерных признаков формирования вируса. В это время происходит образование структурных вирусных белков и нуклеиновых кислот, из которых в дальнейшем происходит организация нуклеиновой кислоты и капсомеров в единую структуру, условно называемую нуклеокапсидом, или виронуклеоном. Считают, что это происходит по принципу самосборки и осуществляется с помощью физико-химических процессов. По-видимому, нарушение процессов сборки приводит к формированию неполноценных форм вируса. Указанные процессы происходят в разных участках ядра, и постепенно в нём накапливается множество диффузно рассеянных виронуклеонов. Диаметр иуклеотида 35–55 нм, а заключающего капсида 75–85 нм. В результате того, что виронуклеоны являются правильными пространственными фигурами (икосаэдрами), при определённых условиях они приобретают общую кристаллоподобную организацию. Данные литературы позволили предположить несколько возможных путей формирования включений, Известно, например, что вирусное потомство включает не более 20 % вновь синтезированной ДНК и около 35 % белка. Исходя из этих данных, можно считать, что та часть нуклеиновой кислоты и структурных белков, которая остаётся неиспользованной при формировании вируса, и может образовывать включения. Цикл размножения вируса ИРТ КРС продолжается около 10 часов. Продолжительность периода эклипса составляет при ИРТ около 8 часов. В культуре клеток, заражённых вирусом, вирусные белки появляются через 2 часа и накапливаются в максимальных количествах приблизительно через 8 часов. Вирусная ДНК обнаруживается на 1 час позже, чем вирусные белки, и имеет сходную кинетику образования. Сходные инфекционные вирионы появляются через 10 часов и достигают наивысших титров через 15 часов. Массовый выход вирусных частиц из клетки происходит между 15 и 18-ю часами и сопровождается образованием множества структур типа пластинчатого комплекса. В поздние сроки заболевания, в момент разрушения клетки за её пределы попадают различные типы вирусных частиц, находящиеся на разных стадиях формирования. Некоторые вирусные частицы, находящиеся в ядре, цитоплазме, на поверхности клеток и в межклеточных пространствах, бывают без нуклеоида. Дефектный вирус, в частности без нуклеоида, не обладает инфекционной активностью. Несмотря на это “пустые” виронуклеоны, как и “полные”, приобретают оболочку во время продвижения по клетке.
Для выявления антигенного родства между герпесвирусами различных видов животных и человека были проведены исследования. Штерн с соавторами. (1984)установили антигенное родство между вирусом Herpes simplex (тип 1) и вирусом мамиллита крупного рогатого скота, а Блю и Плюммер (1969)обнаружили антигены, общие для вируса Herpes simplex (тип 1), герпесвируса обезьян, вируса ИРТ КРС и вируса аборта кобыл (EHV-1). Результаты других исследований подтвердили эти данные.
Физико-химическая характеристика вируса ИРТ КРС изучена достаточно полно. Вирус термолабилен; он инактивируется при 50–52 °C в течение 30 минут. При 37 °C наступает инактивация вируса в течение 10 часов. При изучении различных факторов, влияющих на термостабильность вируса, показано, что при добавлении хлористого магния, сернокислого магния, фосфорнокислого калия и хлористого калия она резко уменьшается. Растворы формалина 1:500 инактивируют вирус через 24 ч, 1:5000 – через 6 ч. Ацетон, эфир, хлороформ и этиловый спирт инактивируют его немедленно. Вирус, ресуспендированный в водной среде, содержащей аминокислоты или белок, более стабилен. Наибольшая термостабильность вируса наблюдается при рН 6,5–6,9.
Вирус устойчив к воздействию низких температур. При -70 °C он может длительно сохраняться. После хранения при 4 °C через 20 недель титр снижается на 5,5 lg, а при хранении в тот же период при -20 °C и -70 °C на 0,5 и 0,1 lg соответственно. Вирус устойчив при 4 °C в 5 % растворе глицерина. Применение снятого молока позволяет сохранить инфекционный титр вируса без его изменения в течение 5 месяцев при -70 °C. Вирус хорошо лиофилизируется в присутствии фрагментов ткани и при этом может сохраняться годами. Вирус ИРТ чувствителен к эфиру, что связано с наличием липидов в оболочке. Он весьма устойчив к ультразвуку, а также к повторному замораживанию и оттаиванию. Имеются сообщения о выживании вируса в сперме быков, хранящейся при температуре сухого льда, в течение 4-12 мес., а в жидком азоте – в течение года.
Облучение ультрафиолетовыми и рентгеновскими лучами может разрушить вирус даже при небольших дозах воздействия.
1.3. Патогенность вируса инфекционного ринотрахеита КРС для лабораторных животных
Иммуногенность коммерческих вакцин против ИРТ КРС не контролируют на лабораторных животных, в связи с отсутствием вируса, способного преодолеть их естественную резистентность. Поэтому предпринимаются многочисленные попытки исследования по адаптации вируса ИРТ КРС к организму различных видов животных.
За последние годы появились сообщения, что вирус ИРТ КРС патогенен для кроликов, хомяков, хорьков, норок. Экспериментально доказано, что вирус ИРТ КРС можно адаптировать к организму хомяков, хорьков, норок, кроликов. Однако, до настоящего времени ни один из видов этих животных не используется при контроле иммуногенности вакцин против ИРТ КРС в виду недостаточно чёткой клинической картины и слабых изменений в органах. Некоторые авторы сообщают, что наряду с другими видами лабораторных животных, при экспериментальном изучении инфекции широко используют золотистых сирийских хомяков, т. к. они восприимчивы к возбудителям ряда инфекционных заболеваний, удобны в использовании, содержание и разведение их просты, они менее подвержены эпизоотиям, наблюдающимся у кроликов, морских свинок, белых мышей.
С учётом литературных данных для проведения исследований по возможной адаптации вируса ИРТ КРС мы выбрали хомяков, как наиболее удобное и недорогое животное. В результате проведенных исследований нами впервые получен штамм вируса ИРТ КРС, адаптированный к золотистым сирийским хомякам, вызывающий их заболевание в 100 % случаев (в зависимости от способа заражения) с последующей гибелью до 80 % животных. Пассирование исходного полевого вируса ИРТ КРС, штамм ТНЛ-2, через организм семидневных хомяков обуславливает изменение биологических свойств. В процессе пассирования на семидневных хомяках вирус повышает свою вирулентность для животных данного вида и вызывает заболевание и гибель хомяков более старшего возраста. Адаптированный вирус локализуется в лёгких, головном мозге, печени, селезёнке, почках и вызывает у них характерную клиническую картину: вялость, взъерошенность шёрстного покрова, отказ от корма, конъюнктивит.
При патологоанатомическом исследовании наблюдали увеличение лёгких, селезёнки, точечные кровоизлияния в мозге, а в печени при гистологическом исследовании отмечали инфильтрацию лимфоидными клетками. Вирулентность адаптированного вируса для хомяков семидневного вируса при подкожном и интрацеребральном методе заражения достигала 5,7–6,0 log ТЦД50/мл.
Проведёнными исследованиями нам не удалось адаптировать исходный вирулентный вирус ИРТ КРС, штамм ТНЛ-2, к организму морских свинок, крыс и мышей. Поэтому было решено испытать чувствительность к перечисленным лабораторным животным вируса ИРТ КРС, адаптированного к золотистым сирийским хомякам. Адаптированный к сирийским хомякам вирус ИРТ КРС был вирулентен для беспородных белых мышей и вызывал гибель животных в возрасте от 7 до 21 дня. Клиническая картина болезни у белых мышей характеризовалась угнетённым состоянием, отказом от корма, взъерошенностью шёрстного покрова, конъюнктивитами, гиперемией носовой полости. На вскрытии павших и убитых в агональном состоянии животных обнаруживали увеличение лёгких, селезёнки, некротические очаги в печение, точечные кровоизлияния в головном мозге. При гистологическом исследовании головного мозга отмечали гиперемию сосудов, отёк мозга и лёгких, зернистую дистрофию печени.
Вирулентность вируса для мышей составила 5,0–5,75 lg ТЦД50/мл.
Гибель животных превышала 70 % при подкожном и интрацеребральном методах заражения. Пассированный вирус титровался на мышах, его инфекционная активность составляла 5,25-5,75 lg ТЦД50/мл. При совместном содержании больных и здоровых мышей в возрасте до 21 дня происходила передача вируса последним, они переболевали в лёгкой форме. Полученные результаты исследований по адаптации вируса ИРТ КРС к организму хомяков и белых мышей до 21-дневного возраста – послужили основанием для использования этих животных в качестве лабораторной модели при контроле иммуногенности вирусвакцины против ИРТ КРС. В опытах на хомяках и мышах было установлено, что эти животные не чувствительны к исходному (полевому) вирусу ИРТ. При заражении их этим вирусом они не заболевают, но становятся устойчивыми при контрольном заражении адаптированным к их организму вирусу.
Таким образом, показана принципиальная возможность для проведения детальных исследований по разработке метода контроля иммуногенной активности вирус вакцины на лабораторных животных.
1.4. Эпизоотология инфекционного ринотрахеита КРС
В естественных условиях к вирусу восприимчив крупный рогатый скот всех пород и возрастов. Молодые животные более восприимчивы. Болезнь у них протекает тяжелее. Молочный скот болеет легче, чем мясной. Нет особых различий в восприимчивости к болезни животных разного пола. Заболевание может возникнуть в любое время года, независимо от климатических условий, чаще оно регистрируется осенью, зимой и весной.
Овцы, козы, олени переболевают бессимптомно и могут оставаться скрытыми вирусоносителями. Антитела к вирусу ИРТ КРС обнаружены у свиней, бегемотов, буйволов, бородавочников и газелей. Предполагают, что в странах Африки антилопа гну является латентным носителем вируса ИРТ КРС.
Вирус передаётся аэрозольно, с носовыми выделениями, контактно, со спермой, при пересадке яйцеклеток. При половом акте, инфекция, как правило, передаётся от быка к корове. Такой путь передачи не исключается и при искусственном осеменении, потому что даже при соблюдении всех мер предосторожности вирус передается со спермой. При получении семени, быки зачастую заражаются через чучело.
Вирус, проникающий в незащищенное стадо, может вызвать острое заболевание животных с максимальным охватом поголовья крупного рогатого скота. Пик выделения возбудителя в окружающую среду приходится на первые 4–6 месяцев после заражения.
Впервые инфекция бычьего ринотрахеита была описана в 1950 году в Колорадо и Калифорнии. Экспорт крупного рогатого скота и семени из США почти на все континенты впоследствии распространил новую респираторную болезнь по всему миру.
В 1960 году в Европе стало известно о бычьем герпесвирусе 1-го типа как возбудителе половых инфекций крупного рогатого скота.
В Великобритании в 1961 году ИРТ КРС зарегистрировали, но серьёзного внимания ему не уделяли вплоть до 1978 года. В 1979 году инфекция распространилась по всей стране. Падёж (8 %) послужил поводом к углублённому изучению возбудителя болезни и разработке мер профилактики. В 1996 году распространенность конъюнктивита и генитальных поражений составила 86 % и 81 % соответственно. Ежегодные потери исчислялись в 5,7 млн. фунтов стерлингов.
С 1978 года ИРТ КРС регистрируется в Швейцарии, с 1980 – в Дании, с 1981 – в Италии. В настоящее время болезнь регистрируется практически во всех странах мира и наносит животноводству значительный ущерб. В России заболевание впервые наблюдал Н.И. Пономаренко в 1938 году и описал его в 1940 году под названием “инфекционный катар дыхательных путей”.
ИРТ КРС получил широкое распространение в нашей стране и регистрируется во многих субъектах Российской Федерации.
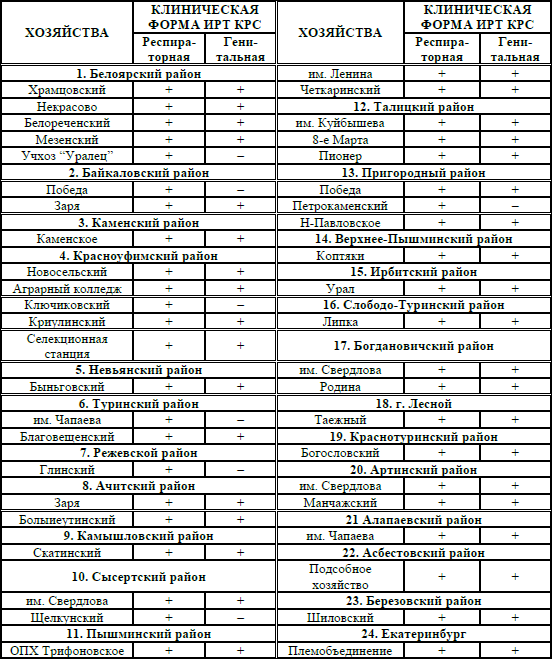
В Свердловской области заболевание регистрируется с 1985 года. Наблюдения последних лет показали, что ИРТ КРС распространён в 16 племенных и 111 товарных хозяйствах области (табл. 1). В племенных хозяйствах чаще регистрируется вирусоносительство ИРТ КРС. По причине ИРТ погибает от 1 % до 30 % телят. ИРТ КРС открывает путь хроническим респираторным болезням, которые в 50 % случаев являются причиной выбраковки скота.
Таблица 1 – Распространение ИРТ КРС в Свердловской области в зависимости от географической зоны

Анализ результатов серологических исследований показывает, что ИРТ КРС распространён, в основном, в Восточных и Юго-восточных районах Свердловской области, где инфицированность животных достигает 100 %. В этих районах имеется импортированный скот, отмечается высокая концентрация животных, высокая интенсивность ведения животноводства и широкий охват животных искусственным осеменением.
На Севере и Юге региона незначительное распространение ИРТ КРС (до 45–65 %) связано с небольшим количеством животноводческих ферм, а также слабым охватом животных искусственным осеменением.
Дальнейшими исследованиями установили, что заболевание имеет широкое распространение на территории Урала, где встречаются практически все известные клинические формы. На основании серологических и вирусологических исследований вспышки болезни регистрировали в 24 районах, 47 хозяйствах Свердловской области (табл. 2). При исследовании 15368 проб сыворотки крови антитела к вирусу ИРТ КРС выявляли в 20–70 % проб, полученных от телят и коров при массовых респираторных и гинекологических заболеваниях в зависимости от типа хозяйств.
1.5. Способ передачи вируса инфекционного ринотрахеита КРС
Инфекция передаётся от быка корове при половом акте. Такой путь передачи не исключается и при искусственном осеменении. При хранении спермы в жидком азоте также возможно проникновение вируса ИРТ КРС из инфицированного материала в стерильную сперму.
Таблица 2 – Неблагополучие хозяйств Свердловской области по ИРТ КРС на 01.01.2005 г.

Из быков, используемых на искусственном осеменении, наибольшую опасность представляют те, которые выделяют вирус, не обнаруживая клинических симптомов. Обычно – это реинфицированные быки, или животные, находящиеся в инкубационном периоде.
При искусственном осеменении быки часто заражаются через чучело. Важную роль играет число восприимчивых особей в стаде, так как вирулентность вируса возрастает при быстрых многократных пассажах на животных.
Вирус в большом количестве выделяется из носовой полости, при этом он легко может передаваться находящимся рядом животным, что приводит к быстрому повышению вирулентности возбудителя в респираторном тракте. В переносе болезни или её проникновении в стадо особую роль играют те животные, которые могут быть переносчиками, но сами при этом не проявляют никаких симптомов заболевания. Существует четыре типа носителей вируса:
♦ животные, у которых после переболевания образовался иммунитет, но вирус в течение нескольких дней слабо размножается в респираторном тракте и выделяется из организма;
♦ животные, у которых титры вируснейтрализующих антител понизились, что дает возможность реинфекции;
♦ латентные вирусоносители;
♦ животные, у которых колостральный иммунитет находится на стадии затухания.
У некоторых животных вирус проникает в центральную нервную систему, кровь. Нейротропные штаммы вируса могут поселяться в лейкоцитах, проникать в другие клетки и там размножаться.
Ранние аборты у животных могут наблюдаться при быстром проникновении вируса в систему кровообращения плода, затяжные аборты – при прогрессирующем переходе вируса от клетки к клетке. При этом вирус проникает из материальной части плаценты, непосредственно в плодную часть через систему кровообращения.
Заболевание глаз (конъюнктивиты), вызванные вирусом ИРТ КРС, чаще передаётся через насекомых. Скопление мух ниже внутреннего угла глаз зачастую является показателем обильного слёзотечения. Заслуживает внимания наблюдение, что чаще всего поражается один глаз. Причина, по-видимому, заключается в том, что, во-первых, болезнь переносится насекомыми, а во-вторых, глаза у крупного рогатого скота расположены латерально и контакт с больным животным чаще происходит с одной стороны, а не одновременно с обеих. Если бы в развитии инфекционного процесса постоянно участвовал носослёзный канал, заболевание всегда было бы двухсторонним.
1.6. Роль вируса инфекционного ринотрахеита КРС в этиологии массовых вспышек острых респираторных и гинекологических заболеваний у животных
Известно, что введение в восприимчивое стадо животного вирусоносителя – лучший способ заноса возбудителя инфекции.
Значительную роль в распространении ИРТ КРС играют быки-производители. По данным многих авторов даже незначительная контаминация спермы вирусом ИРТ КРС после осеменения ей серонегативных коров и тёлок приводит к развитию у них клинических признаков заболевания и сероконверсии, при этом причиной половой инфекции коров являются больные и переболевшие ИРТ КРС быки-вирусоносители.
При изучении роли вируса ИРТ КРС в этиологии массовых респираторных и гинекологических заболеваний крупного рогатого скота за основу для анализа были взяты данные вирусологических и серологических исследований, проведённых в племенных хозяйствах Свердловской области. При исследовании 28281 проб сыворотки крови (данные областной ветеринарной лаборатории) антитела к вирусу ИРТ КРС выявили в 88,5 % проб, полученных от быков, коров, тёлок, телят при массовых респираторных и генитальных заболеваниях, что свидетельствует о напряжённой эпизоотологической ситуации в области (табл. 3).
Таблица 3 – Распространение ИРТ КРС в Свердловской области

Нам удалось установить связь между введением контаминированной вирусом спермы в хозяйство и возникновением в нём гинекологической патологии у животных 16 племенных хозяйств.
В 1986 году исследовали пробы спермы и сыворотки крови быка “Таил”, принадлежащего Свердловскому головному племпредприятию. У этого быка отмечали ослабление полового рефлекса и повышенное бактериальное загрязнение спермы. В результате исследований выделили вирус ИРТ в культуре клеток ПЭК, а в пробах сыворотки крови, полученного от быка – антитела к вирусу ИРТ КРС в титрах 1:64. В 1986 году в нескольких хозяйствах Белоярского района Свердловской области, где применяли сперму быка “Таил” были зарегистрированы массовые вспышки острого респираторного заболевания телят и гинекологических болезней коров и тёлок.
Анализ воспроизводства, проведённый в 16 хозяйствах, показал, что за двухлетний период в них было осеменено 48456 коров и тёлок, получено 38756 телят. Из них до 6-ти месячного возраста пали 11630, что в среднем по хозяйствам составляет 30 %. При этом этиологическую роль вируса в развитии гинекологических заболеваний у коров установили в 10, а в возникновении респираторных болезней телят – во всех 16 хозяйствах. Течение основного заболевания у животных сопровождалось развитием секундарной инфекции и чаще всего протекало субклинически и оставалось незамеченным, представляя угрозу в распространении возбудителя. Отмечено, что такие коровы в дальнейшем становились источником возбудителя инфекции для телят. При осеменении инфицированной спермой коров у них отмечали слабые серозно-слизистые выделения из половых органов. Температура тела повышалась до 40,5 °C на 3–4 день после введения контаминированной вирусом спермы, затем к 6–9 дню достигала нормы. Отмечали слизисто-гнойные, гнойные и ихорозные выделения из влагалища различной интенсивности. У больных быков-производителей наблюдали баланопоститы с появлением на препуции и пенисе пустул и язв, с отёчностью и болезненностью.
Количество абортов, вызванных вирусом ИРТ КРС, при которых удалось доказать его этиологическую роль обычно не превышали 5-11 %. Их регистрировали чаще у первотёлок, чем у взрослых коров. Это вызвано низким, на наш взгляд, уровнем или отсутствием иммунитета у первотёлок.
Часто регистрировали мёртворожденных телят вследствие их гибели в матке, при этом отмечали сильные аутолитические изменения во внутренних органах. Если телята рождались живыми, то приблизительно 10 % случаев у них регистрировали острую катаральную бронхопневмонию с последующей гибелью в течение 3-х суток.
В дальнейшем такие хозяйства становились стационарно неблагополучными по ИРТ КРС. Количество животных с острым течением ИРТ КРС постепенно снижалось, инфекция переходила в латентную форму, и регистрировались рецидивы болезни связанные с нарушением кормления и технологии содержания, различными стрессами вводом новых животных в инфицированное стадо, или, вирусоносителя в неиммунное стадо, что приводило к обострению ситуации и возникновению новых вспышек заболевания.
Известно, что максимальным сроком использования спермы одного быка-производителя в хозяйстве является 2–3 года. По истечении этого срока семя быка направляется в другие хозяйства. Кроме того, по окончании срока использования в качестве донора спермы (5–7 лет), а также по причине различных заболеваний быки-производители выбраковываются. Однако, на племпредприятии остается значительный запас семени, полученной от них за период эксплуатации. Известно, что вирус ИРТ КРС способен сохраняться многие годы при хранении в условиях глубокой заморозки, не теряя при том своей патогенности для “чистых” животных. Учитывая приведенные данные, становится очевидным, что с использованием инфицированной спермы риск распространения ИРТ КРС в хозяйствах значительно возрастает.
В таблице 4 приведены результаты анализа воспроизводства в хозяйствах, где использовалась контаминированная вирусом сперма, полученная из спермохранилища.
Таблица 4 – Анализ воспроизводства в племенных хозяйствах, где использовалась контаминированная вирусом ИРТ КРС сперма

Выборка произведена за 2 года. Приведённые данные по 16 хозяйствам, показывают, что инфицированной спермой в них было осеменено 28402 коров и телок, получено 22721 телёнок. Из них до 6-ти месячного возраста пало 1506 голов, что составляет 24 %. При этом этиологическую роль вируса установили в 16 хозяйствах. Однако, потери в животноводстве значительно высокие если учитывать затраты на лечение вакцинацию и проведение ветеринарно-санитарных мероприятий.
1.7. Инфекционный ринотрахеит КРС среди животных частного сектора
В связи с созданием мелких товарных ферм, значительного увеличения поголовья крупного рогатого скота в частных хозяйствах возникла необходимость изучения особенностей течения и проявления ИРТ КРС в новых условиях содержания животных.
Из анамнеза, проводимого в хозяйствах, было известно, что во время массовых вспышек острых респираторных болезней телят на фермах часто болеет скот частного сектора, как принадлежащий работникам фермы, так и нет.
Предварительные эпизоотологические данные указывают на то, что источником инфекции, возможно, является поголовье крупного рогатого скота, содержащегося в крупных хозяйствах.
В частном секторе г. Верхотурья и г. Шаля Свердловской области среди телят, коров, быков выявили в сыворотке крови вируснейтрализующие антитела к вирусу ИРТ КРС в титрах 1:2–1:16. В сперме 5 быков обнаружили ДНК вируса ИРТ КРС.
Полученные результаты свидетельствуют о том, ИРТ КРС имеет распространение и среди животных частного сектора, что указывает на необходимость их вакцинации против этого заболевания. Причинами возникновения заболевания среди животных частного сектора являются: механический перенос возбудителя работниками животноводческих ферм от больных телят общественного стада к частным, искусственное осеменение коров частного сектора, либо со спермой быков-производителей, получаемой из племпредприятия, либо вследствие естественной случки с быками вирусоносителями частного сектора или общественного стада.
Следует отметить, что у коров и быков частного сектора, характерных симптомов ИРТ КРС наблюдать не удавалось, а у телят постоянно обнаруживали симптомы острой катаральной бронхопневмонии, аналогичные таковым у общественных телят крупных хозяйств, где содержится большое поголовье молодняка на сравнительно ограниченной территории. Из этого следует, что утверждение некоторых авторов, о влиянии различных факторов на течение инфекционного процесса при ИРТ КРС в значительной мере преувеличено.
1.8. Особенности эпизоотического процесса инфекционного ринотрахеита КРС в племенных хозяйствах
В последние годы заболевание в племенных хозяйствах Свердловской области имеет тенденцию к течению в латентной форме.
Особенностью современной эпизоотической ситуации является то, что на племпредприятии выявлены быки-производители, у которых заболевание протекает, в основном, латентно. Вирус находится в организме этих животных в латентном состоянии, что проявляется отсутствием видимых признаков заболевания в течение длительного времени, низким уровнем вируснейтрализующих антител, трудностью выделения возбудителя из спермы. Однако, в периоды рецидивов болезни возбудитель выделяется во внешнюю среду, не теряя при этом вирулентности для других животных.
С учётом этого племпредприятие является источником формирования зоны повышенного риска возникновения ИРТ КРС.
Так, например ФГУП “Свердловское” в течение 12 лет оставалось неблагополучным по данному заболеванию и постоянно поставляло в хозяйства области и за её пределы инфицированную сперму. Контаминация спермы быков-производителей вирусом ИРТ КРС определяется нами уже в течение 12 лет.
В 1995–2002 годы ИРТ КРС среди быков-производителей составлял от 0,60 до 1,89 % от общей патологии в Свердловском племпредприятии (М = 0,85+0,42). Экстенсивные показатели эпизоотического процесса ИРТ КРС среди быков-производителей на племпредприятии имели выраженное непостоянство. Так, в 1997 году по сравнению с 1996 годом количество выявленных вирусоносителей на Свердловском племпредприятии уменьшилось, что по всей вероятности связано с иммунизацией их инактивированной вакциной против ИРТ КРС, которая, скорее всего, частично сдерживает выход вируса из латентного состояния и сокращает количество рецидивов заболевания на определенный срок. Формирование поствакцинального гуморального иммунитета, по всей видимости, подавляет инфекцию вируса, снижая количество и остроту рецидивов заболевания.
Антитела не проникают в инфицированные или в нервные ганглии, где вирус находится в “разобранном” виде, лишённый белковой оболочки, и не могут обеспечить полной элиминации возбудителя.
Интенсивные показатели эпизоотического процесса при латентной форме ИРТ КРС не имеют выраженного постоянства. Закономерностей в частоте реактивации вируса из латентного состояния не наблюдалось, так как ДНК вируса выявляли не во всех пробах семени быков, полученных за определенный период времени. Отмечено постоянное превышение превалентности над инцидентностью (в 1,9–3,8 раза), что подтверждает постоянное наличие источника возбудителя инфекции. В годовой динамике устанавливали вирусоносительство 9-12 % и 20–30 % из исследованных быков-производителей и эпизоотические надбавки, связанные с племпродажей, в 4,9–6,1 %.
Эпизоотический процесс ИРТ КРС формируется под воздействием:
♦ эндо– и экзогенных факторов, способствующих реактивации вируса и выделения его во внешнюю среду;
♦ увеличения количества вирусоносителей за счёт вовлечения в эпизоотический процесс новых групп животных;
♦ выраженных иммунодефицитов, так как при количественном определении иммуноглобулинов в сыворотке крови быков-производителей, больных ИРТ КРС в латентной форме, выявили значительное снижение их уровня.
Эпизоотические надбавки в годовой динамике эпизоотического процесса ИРТ КРС среди быков-производителей определяются четырьмя элементами:
♦ появлением в стаде быков-производителей (вирусоносителей);
♦ стрессами;
♦ иммунодефицитами;
♦ появление достаточно большого (55 %) процента ремонтного молодняка.
На этом фоне, учитывая широкие масштабы использования спермы быков-производителей для искусственного осеменения коров, риск распространения инфекции значительно возрастает.
1.9. Спектр возбудителей инфекционных заболеваний от телят неблагополучных по инфекционному ринотрахеиту КРС племенных хозяйствах
Течение ИРТ КРС у телят часто осложняется развитием вторичной микрофлоры, или протекать совместно с другими вирусными заболеваниями.
Наиболее часто в качестве осложняющего течение основного заболевания агента встречается сальмонелла (60 %), при этом от больных телят чаще выделяется S. typhimurium (60 %) и S. dublin (40 %) от общего числа положительных проб. Культуры пастерелл изолировали от больных и павших телят в 30 % случаев, при этом они относились к сероварам А, В, Д и обладали пониженной вирулентностью.
Следует отметить, что культуры пастереллы изолировали, в основном, в период 1998–2000 гг. от телят различного возраста в крупных племенных хозяйствах. В период 1998–2000 гг. эти микроорганизмы присутствовали в пробах биоматериала от телят, полученных из мелких племенных хозяйств спорадически. Культуры сальмонелл, наоборот, до 1999 года выделяли редко, а, начиная с 1999–2000 гг. удельный вес их возрос до 60 %. На наш взгляд это связано с тем, что в хозяйствах зачастую не проводятся мероприятия по специфической профилактике сальмонеллеза крупного рогатого скота (табл. 5).
Кроме того, от телят 1–6 месячного возраста изолировали культуры стрептококков (25 %), стафилококков (20 %), а также вирус парагриппа-3 (27 %) и аденовирусы (3 %), микоплазмы (5,1 %), хламидии (3,2 %).
Таблица 5 – Спектр возбудителей инфекционных заболеваний, выделенных от телят в стационарно неблагополучных по ИРТ КРС


От телят 1-месячного возраста выделяли E. coli (35 %), диплококки (10 %), рота– (28 %) и коронавирусы (33 %), а также перечисленные выше микроорганизмы.
Кроме того, отмечали различные ассоциации вирусов и бактерий. Чаще всего ИРТ КРС протекал совместно с парагриппом-3 КРС (особенно у телят 1–4 месяцев), аденовирусной инфекцией и инфекцией, вызванной вирусом ВД-БС КРС. Следует отметить, что процент положительных на аденовирус и вирус ВД-БС проб был невысоким (7,6 %), что вероятно, можно объяснить либо снижением степени участия этих вирусов в этиологии массовых респираторных заболеваний телят, либо недостаточной чувствительностью к ним культуры клеток MDBK, в которых проводили их выделение.
В большинстве племенных и товарных хозяйств Свердловской области выявляются смешанные вирусные и вирусно-бактериальные инфекции. В 76 хозяйствах (83 %) из 91 обследованного встречались случаи сочетания парагриппа-3, ИРТ КРС, хламидиоза (9,2 %), парагриппа-3, вирусной диареи, микоплазмоза (2,1 %), парагриппа-3, ИРТ КРС, ВД-БС КРС (39,8 %), ИРТ КРС и сальмонеллёза (1,4 %), ИРТ КРС и колибактериоза (5,8 %), ВД-БС, парагриппа-3 и сальмонеллеза (4,3 %), парагриппа-3, рота-коронавирусные инфекции, колибактериоз, ИРТ КРС, ВД-БС, (16,5 %), парагрипп-3 ИРТ КРС, ВД-БС, стафилококковая инфекция (4 %) (табл. 6).
Таблица 6 – Ассоциации смешанных вирусных и вирусно-бактериальных инфекций в племенных и товарных хозяйствах Свердловской области

1.10. Ассоциации микроорганизмов с вирусами ИРТ, ВД-БС, ПГ-3 крупного рогатого скота
Особенность ОРВИ КРС состоит в том, что они протекают в виде смешанных инфекций и, как правило, осложняющихся бактериальными. В таких случаях иногда проявляется синергизм – усиление патогенности одного вида микроба под влиянием другого.
Секундарная инфекция имеет эндогенный характер, ее возбудители обычно условно-патогенные микробы, обитающие на слизистых оболочках дыхательных путей, кишечника как комменсалы. Они активизируются только при снижении резистентности организма. Особенно часто вторичная инфекция развивается на фоне болезней, вызываемых вирусами. Патогенное действие пастерелл и сальмонелл, например, осложняет течение инфекционного ринотрахеита, вирусной диареи-болезни слизистых, парагриппа 3 крупного рогатого скота.
Проблема смешанных, вторичных и ассоциативных инфекций стала особенно актуальной в условиях современного промышленного животноводства при большой концентрации животных на ограниченных площадях. В этих условиях значительно осложняется микробный пейзаж. Установлено, в частности, что в возникновении вирусных респираторных болезней крупного рогатого скота могут участвовать вирусы диареи, ринотрахеита, парагриппа, адено-, рота-, коронаподобные вирусы, хламидии, микоплазмы. Зарегистрировано одновременное течение ринотрахеита и диареи у 5-10-месячных телят, доказана возможность развития смешанной инфекции, вызванной вирусами ринотрахеита и парагриппа-3.
Выделение смешанных, вторичных и ассоциативных инфекций носит весьма условный характер. Далеко не всегда можно установить истинную этиологическую роль того или иного агента, провести четкую грань между патогенностью и комменсализмом.
Пастереллез (Pasteurellosis) (геморрагическая септицемия) – инфекционная болезнь многих видов животных и птиц, с явлением септицемии, воспалительно-геморрагическими процессами во внутренних органах, серозных и слизистых оболочках.
Впервые возбудителя холеры кур в чистой культуре выделил Л.Пастер. Возбудитель пастереллеза включает в себя 6 видов: P. multocida; P. haemolitica; P. pneumotropica; P. aerogenes; P. gallinarum чаще обнаруживаются в ассоциации с возбудителями других респираторных инфекций, имеющих хроническое течение. Ведущее этиологическое значение в патологии животных принадлежит двум пастереллам: P. multocida, серовары А, В, D и P. haemolitica, биотип А.
Устойчивость во внешней среде невысокая. При температуре 58 °C погибают за 20 мин., при 90 °C – за 10 мин., при кипячении – моментально. При высушивании гибнут за 2–3 суток. В почве выживают да 12 дней, в навозе – 14, в гниющих трупах – до 3 месяцев.
К пастереллезу восприимчивы все виду домашних и диких животных, в том числе птица. Более пастереллезом и человек. У него пастереллез чаще всего вызывает Р. multocida, которая попадает в организм аэрогенно, при уходе за больными животными. Кошки, крысы, мыши могут заразить человека при укусе и нанесении царапин. Ухаживающий персонал может заразиться через укусы блох. Определенную устойчивость имеют плотоядные и лошади.
Эпизоотические вспышки пастереллеза с острым проявлением болезни по типу геморрагической септицемии у взрослого крупного рогатого скота и диких жвачных в условиях нашей страны обычно вызывает P. multocida типа В, а в условиях Африки – P. multocida типа Е; молодняка крупного рогатого скота и буйволов – P. multocida типа В и у птиц – P. multocida типа А. в антигеном отношении пастереллы неоднородны. Спорадическую заболеваемость пастереллезом, как правило, проявляющуюся подострым и хроническим течением болезни по типу энзоотической пневмонии, чаще вызывают у телят P. multocida типа А и P. haemolitica.
Пастереллезом в первую очередь заболевает молодняк. Основным источником возбудителя являются больные и переболевшие животные – пастереллоносители, выделяющие возбудителя во внешнюю среду с истечениями из носа, слюной, фекалиями, мочой, молоком. Носительство вирулентных пастереллы продолжается более года и является также причиной вспышки пастереллеза, возникающей при снижении резистентности организма носителей под влиянием неблагоприятных факторов внешней среды.