Глава 1. ФЛУОРЕСЦЕНТНАЯ МИКРОСКОПИЯ И КОНФОКАЛЬНАЯ ЛАЗЕРНАЯ МИКРОСКОПИЯ – ПРИНЦИПЫ И ОСНОВНЫЕ МЕТОДЫ
Большинство биологических объектов обладают низким контрастом внутренних структур, которые в основном прозрачны, поэтому возможности их наблюдения методом классической микроскопии светлого поля ограничены. Эта проблема может быть преодолена несколькими путями: применением метода исследования в темном поле, использованием метода фазового контраста, для двулучепреломляющих материалов применяют поляризационный контраст. Основным же методом контрастирования в биологии является окрашивание препаратов веществами, способными связываться с препаратом и поглощать свет или флуоресцировать. Последние называют флуорохромами.
1.1. Основные понятия
Флуорохромы (флуоресцентные красители)1 – это вещества, которые способны связываться с объектом и расходовать часть энергии поглощенного света на флуоресценцию. Под флуоресценцией понимают способность ряда веществ после поглощения света с одной длиной волны излучать свет с другой длиной волны. Напомним, что электроны в атомах расположены на энергетических уровнях; расстояние между уровнями является характеристикой молекулы. При облучении вещества светом возможен переход электронов на более высокий энергетический уровень. Разница энергии между энергетическими уровнями и частота колебаний поглощенного света связаны между собой уравнением Бора (постулат Бора):

где ΔЕ – разность энергий между уровнями; v – частота; λ – длина волны; h – постоянная Планка; с – скорость света.
После поглощения света часть полученной системой энергии расходуется в виде тепла, а часть может быть излучена в виде фотона. Согласно правилу Стокса, длина волны испускаемого света больше, чем длина волны поглощаемого, или, другими словами, максимум спектра излучения сдвинут по отношению к максимуму спектра поглощения в сторону более длинных волн. С физическими основами описанных выше процессов более подробно можно ознакомиться в учебнике Р. Фейнмана (2011).
Каждый флуорохром характеризуется определенным спектром поглощения и испускания. Например, один из самых распространенных флуоресцентных красителей – FITC (fluorescein-5-isothiocyanate) – имеет максимум поглощения lex = 492 нм, а максимум излучения для него составляет lem = 518 нм. Другой распространенный флуорохром, 5-TAMRA (5-carboxytetramethylrhodamine), имеет lex = 543 нм и lem = 570 нм. На величину стоксова сдвига также влияет полярность среды, в которой находится флуорохром.
Наиболее интенсивной флуоресценции флуорохрома можно добиться, облучая его светом с длиной волны, близкой к максимуму поглощения, однако возможно перевести флуорофор в возбужденное состояние и при облучении его светом с длиной волны, существенно отличающейся от его максимума поглощения. Например, флуорофор можно перевести в возбужденное состояние двумя или тремя длинноволновыми фотонами (мультифотонное возбуждение), что будет эквивалентно возбуждению одним коротковолновым фотоном. Так, возбуждение двумя или тремя фотонами с длиной волны 900 нм эквивалентно возбуждению одним фотоном с длиной волны 450 или 300 нм.
Еще одной характеристикой флуорохрома является квантовый выход – отношение интенсивности поглощаемого и испускаемого света. Квантовый выход (Q) может быть выражен через отношение интенсивности флуоресценции (F) к разности интенсивностей падающего (I0) и выходящего (I) световых потоков:

Заметим, что квантовый выход всегда меньше единицы из-за «стоксовских» потерь. В зависимости от квантового выхода флуорохромы разделяют на слабые и сильные. Современные синтетические флуорохромы, как правило, обладают высоким квантовым выходом и являются сильными.
Для характеристики способности флуорохрома поглощать свет определенной длины волны вводят понятие молярного коэффициента экстинкции, который определяется как оптическая плотность одномолярного раствора вещества при толщине светопоглощающе-
го слоя в 1 см. Молярный коэффициент поглощения имеет размерность л ⋅ моль-1⋅ см -1. Он зависит от природы вещества и от длины волны проходящего света. Величина, полученная путем перемножения молярного коэффициента экстинкции на величину квантового выхода, характеризует яркость флуоресценции флуорохрома при заданной длине волны. Время облучения, при котором флуорохром теряет 50 % яркости, называют фотостабильностью. «Идеальный» флуорохром должен иметь высокий квантовый выход и хорошую фотостабильность. Современные флуорохромы на основе полупроводниковых нанокристаллов (квантовых точек) по этим показателям на порядок превосходят органические соединения (Олейников В. А., 2011).
Еще один важный параметр — время жизни возбужденного состояния, которое определяется как среднее время нахождения молекулы в возбужденном состоянии до того, как вернуться в основное состояние. Время затухания флуоресценции флуорохрома (τ) описывается формулой:

где Г – константа скорости излучательной дезактивации флуорофора; k – обобщенная константа скорости безызлучательной дезактивации.
Обычно время затухания флуоресценции составляет около 10 нс.
Тушением флуоресценции называют любые процессы, которые уменьшают интенсивность флуоресценции данного вещества. К тушению может приводить множество процессов: химические реакции в возбужденном состоянии, перенос энергии, образование комплексов, тушение при столкновениях. К тушению флуоресценции относятся также процессы кажущегося тушения, которое обусловлено оптическими свойствами образца (высокая оптическая плотность, мутность). Для тушения флуоресценции требуется контакт между молекулами флуорохрома и тушителя. Если тушитель диффундирует к флуорохрому, пока последний находится в возбужденном состоянии, и в результате контакта флуорохром возвращается в основное состояние без излучения фотона, говорят о динамическом тушении. Статическое тушение происходит при образовании нефлуоресцирующего комплекса между флуорохромом и тушителем. При увеличении концентрации флуорохрома возможно самотушение флуоресценции как результат поглощения молекулами вещества собственного излучения. Возможно также поглощение флуоресцентного излучения одного флуорохрома другим. К тушителям флуоресценции относят молекулярный кислород, ароматические и алифатические амины, ксенон, пероксид водорода, акриламид, оксид азота, нитрометан, нитроксиды, хлороформ, трихлорэтанол, бромбензол. Следует отметить, что не все флуорохромы тушатся любыми из вышеперечисленных веществ, однако (в зависимости от условий эксперимента) почти всегда можно подобрать эффективную пару флуорохром-тушитель или, напротив, избежать тушения флуоресценции (что более важно в морфологических исследованиях).
Для флуорохромов характерна анизотропия флуоресценции. Анизотропия – это зависимость свойств вещества от направления. При возбуждении поляризованным светом селективно возбуждаются только те молекулы флуорохрома, для которых дипольный момент перехода при поглощении параллелен электрическому вектору возбуждающего излучения. Такое селективное возбуждение частично ориентированного набора флуорохромов приводит к частично поляризованному испусканию флуоресценции. В общем случае анизотропия флуоресценции r выражается формулой:

где Iv и Ih – интенсивности флуоресценции вертикально и горизонтально поляризованного испускания в случае возбуждения образца вертикально поляризованным светом.
При планировании экспериментов с использованием флуорохромов, особенно флуорохромов нового поколения – квантовых точек – необходимо учитывать возможность мерцания флуоресценции. Это стохастический процесс перехода флуорохрома из флуоресцирующего состояния в состояние отсутствия флуоресценции, несмотря на постоянное возбуждение. В результате, при наблюдении за одиночными флуоресцирующими комплексами возникает стробоскопический эффект (зрительная иллюзия неподвижности или мнимого движения предмета при его прерывистом наблюдении). Кроме этого, поскольку время нахождения флуорохрома во «включенном» и «выключенном» состоянии является случайным, сравнение результатов независимых экспериментов при использовании таких флуорохромов затруднено. При конфокальной микроскопии данный эффект может быть компенсирован за счет линейного или покадрового усреднения сканируемых изображений.
1.2. Устройство флуоресцентного микроскопа
Прототип флуоресцентного микроскопа был разработан в начале ХХ в. Августом Келлером, который при конструировании микроскопа использовал в качестве источника света дуговую кадмиевую лампу. Затем немецкий физик Генри Фридрих Зидентопф, работая в оптических мастерских Цейса (в 1907 – 1938 гг. директор лаборатории микроскопии), совместно с Рихардом Зигмонди изобрел (1903) щелевой ультрамикроскоп. Еще через восемь лет (1911) Oskar Heimstдdt сконструировал первый флуоресцентный микроскоп и применил его для исследования явления автофлуоресценции органических и неорганических объектов. Однако в то время было трудно добиться эффективного разделения флуоресцентного сигнала от возбуждающего света. Эта проблема была преодолена Philipp Ellinger и August Hirt в 1929 г., которым удалось разработать так называемый эпифлуоресцентный микроскоп. В предложенной ими конфигурации микроскопа освещение препарата и детекция флуоресцентного сигнала осуществлялась с одной стороны от образца, поэтому объектива достигал только отраженный возбуждающий и излучаемый свет. Прорыв в развитии флуоресцентной микроскопии связан с появлением лазеров (60-е гг. XX в.), с помощью которых удалось добиться высокой степени пространственной и временной когерентности светового пучка. Кроме того, стало возможным эффективно разделять сигналы, используя дихроичные зеркала.
Принципиальная схема современного флуоресцентного микроскопа представлена на рис. 1.
Свет от источника проходит через фильтр возбуждающего излучения. При этом из спектра выделяются только те компоненты, которые необходимы для возбуждения флуоресценции. Затем свет попадает на дихроичное зеркало (светоделитель). Отраженный светоделителем свет попадает в объектив флуоресцентного микроскопа и фокусируется на образце, возбуждая флуоресценцию. Флуоресцентный сигнал (смещенный в длинноволновую область (согласно Правилу Стокса)), а также рассеянное излучение возбуждения достигает светоделителя, но, в отличие от возбуждающего света, проходит через дихроичное зеркало, после чего рассеянное излучение отсеивается эмиссионным фильтром и на детектор попадает только излучение флуоресценции.
Источник возбуждающего света. В настоящее время используются три типа источников света: лампы высокой мощности (ртутные, ксеноновые и их аналоги), диоды и лазеры. Ртутная лампа – это газоразрядный источник света, в котором при электрическом разряде в парах ртути под высоким давлением возникает оптическое излучение преимущественно в ультрафиолетовой области спектра. Такие источники света являются малоэффективными, поскольку они производят большое количество избыточной тепловой и световой энергии по сравнению с энергией, требуемой для возбуждения флуоресценции. Флуоресцентные микроскопы могут быть укомплектованы ртутными лампами мощностью 50 – 200 W. Использование более мощной лампы позволяет возбудить с достаточной эффективностью даже слабый флуорохром, но при этом необходимо учитывать, что увеличение мощности лампы влечет за собой увеличение скорости выгорания флуорохромов.
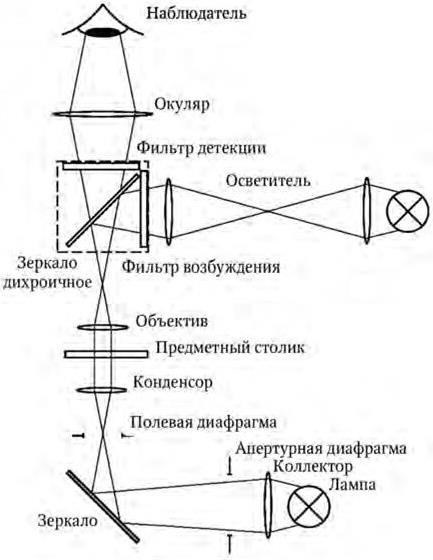
Рис. 1. Принципиальная схема флуоресцентного микроскопа
В ксеноновой лампе вспышка происходит после ионизации газа и прохождении через него мощного импульса электрического тока, поданного на поджигающий электрод. В результате этого электроны в молекуле ксенона занимают орбиты с более высокими энергетическими уровнями и, возвращаясь на прежние орбиты, излучают энергию в виде фотонов. Ксеноновая лампа имеет непрерывный спектр излучения в широком спектральном диапазоне, что не всегда пригодно для возбуждения флуоресценции. Такие лампы обычно используют при работе с флуорохромами, требующими для возбуждения длинноволновый свет (красной и инфракрасной области).
Вместо ртутной или ксеноновой лампы можно использовать металлогалогенную лампу (metal halide lamp). Это газоразрядная лампа высокого давления. Внутри колбы размещается кварцевая или керамическая цилиндрическая горелка, в которой находятся галогениды некоторых металлов (йодиды натрия, таллия, индия и др.), инертный газ (преимущественно ксенон и аргон) и металлическая ртуть. При подаче на лампу питающего напряжения происходит зажигание дугового разряда, металл начинает испаряться, его атомы возбуждаются, что приводит к возникновению излучения. В зависимости от состава металлов различаются и спектры излучения ламп. Обычно компоненты подбираются так, чтобы компенсировать недостаток красного и желтого света в спектре ртути, что немаловажно при использовании возбуждаемых светом этого диапазона флуорохромов (например, флуоресцеина). Кроме этого, лампы данного типа компактны, экономичны в использовании, для них характерен пониженный уровень тепловой отдачи.
Источник возбуждения флуоресцентного излучения может быть выполнен в виде одного или нескольких светоизлучающих диодов, причем возможно использование диодов, имеющих как одинаковую длину волны излучения, так и различную. Применение светодиодов позволяет избежать нагревания системы, увеличивает срок ее эксплуатации.
Лазеры в качестве источника света используются в основном в сканирующих устройствах для обеспечения высокой интенсивности освещения в узкой спектральной области и на малой площади образца. В таких микроскопах остросфокусированные световые лучи лазера сканируют образец точку за точкой. Поскольку лазеры испускают свет в узкой спектральной области, пропадает необходимость применения возбуждающих светофильтров. Однако при использовании флуорохромов, которые возбуждаются на разных длинах волн, требуется применять разные лазеры или же прибегать к различного рода приемам.
Фильтры.
Фильтр возбуждающего света подбирается таким образом, чтобы он выделял из спектра лампы свет той длины волны, которая максимально эффективно поглощается флуорохромом. Например, выпускаются светофильтры под стандартные флуорохромы для «синей», «зеленой», «красной» люминесценции или под несколько стандартных флуорохромов (например, возбуждающий светофильтр BP 560/40 нм для «красной» люминесценции или возбуждающий светофильтр под несколько флуорохромов BP 370/40, BP 474/28, BP 585/35 нм производства фирмы Carl Zeiss).
Дихроичные зеркала (интерференционные светофильтры) имеют специальное интерференционное покрытие, позволяющее отражать свет, длина волны которого меньше определенного значения, и пропускать излучение с большей длиной волны. В данном случае возбуждающее излучение отражается, а сигнал флуоресценции полностью пропускается. Для получения таких фильтров на поверхность прозрачной пластины наносят несколько (от 10 до 200) слоев материала с чередующимися высоким и низким показателями преломления. Например, PbCl2, TiO2, ZnS (показатель 2,2 – 2,3) и MgF2, SiO2, Na3AlF6 (показатель 1,3 – 1,4). Толщина каждого слоя тщательно выдерживается (используется техника вакуумного напыления), поскольку этот параметр определяет положение максимума кривой пропускания. От числа слоев зависит ширина зоны пропускания фильтра и степень подавления «ненужной» части спектра.
Запирающие фильтры (band pass BP). При конструировании запирающих фильтров используют комбинацию длинноволновых отрезающих (shot pass filter, или SP filter) и длинноволновых пропускающих (long pass filter, или LP filter) фильтров. Первые задерживают длинноволновый свет, но пропускают коротковолновый, а LP-фильтры, напротив, пропускают длинноволновый свет, задерживая коротковолновый. Комбинируя эти фильтры, можно добиться того, что через фильтр будет проходить только свет определенного участка спектра. Запирающий фильтр выбирают в соответствии с фильтром возбуждающего света. Например, при установке возбуждающего светофильтра BP 560/40 нм используют запирающий светофильтр BP 630/75 нм.
Сближение в пространстве всех светофильтров позволило объединить их в единый светоделительный модуль. Такая конструкция обеспечивает производство легкой замены или смены модуля и дает возможность применять несколько флуорохромов одновременно, с высокой точностью совмещая полученные изображения. При приобретении флуоресцентного микроскопа необходимо серьезно подходить к вопросу о выборе светоделительных модулей, принимая во внимание поставленные задачи и спектральные характеристики имеющихся флуорохромов. Если планируется использовать несколько флуоресцентных красителей, необходимо учитывать, что спектры излучения флуорохромов не должны перекрываться. В противном случае возможны ошибки в интерпретации данных.