РАЗДЕЛ I. ОБЩАЯ МИКРОБИОЛОГИЯ
Глава 1 ИСТОРИЯ РАЗВИТИЯ МИКРОБИОЛОГИИ
История изучения любой научной дисциплины дает возможность проследить процессы ее возникновения и развития, понять преемственность идей, уровень современного состояния науки и горизонты дальнейшего прогресса. В развитии микробиологии четко прослеживаются три этапа ее становления как науки.
Первый этап – описательный. Начало этого этапа связывают с научной деятельностью Энтони ван Левенгука. Этот менеджер по продажам тканей имел довольно оригинальное хобби – шлифовать линзы и рассматривать при большом увеличении самые разнообразные биологические субстраты. В 1675 г. он сообщил в Лондонское королевское общество, что в дождевой воде ему удалось обнаружить «живых зверьков» (viva animalcule). Свои наблюдения опубликовал в монографии «Тайны природы, открытые Левенгуком», где детально описал и обрисовал открытые им микроорганизмы. Таким образом, Левенгука следует считать отцом микрографии — описательной микробиологии.

Энтони ван Левенгук
Справедливости ради следует отметить, что задолго до открытия Левенгука многие ученые высказывали гипотезы о материальной причине возникновения инфекционных болезней. Еще Тит Лукреций Кар предполагал, что инфекционные болезни вызываются определенными семенами. Аналогичные взгляды проповедовал и известный врач Средневековья Джироламо Фракасторо. Но ни у кого из них не было научных доказательств.
Второй этап – физиологический.
Его начало связывают с именем французского химика Луи Пастера. Именно он впервые выяснил роль микроорганизмов в природе и жизни человечества. В 1875 г. Пастер показал, что процессы брожения и гниения обусловлены жизнедеятельностью микроорганизмов, а не действием химических веществ. Заслугой Пастера следует также считать доказательства анаэробного (без доступа воздуха) существования микроорганизмов.

Луи Пастер
Ранее в среде ученых бытовало мнение о возможности самопроизвольного зарождения микроорганизмов. Пастер с помощью довольно оригинальных опытов опроверг это утверждение – впитательныхсредах, простерилизованных при высокой температуре и соответствующем давлении пара, микроорганизмы никогда не обнаруживались. Однако, когда среды были недостаточно простерилизованы и в сосуды имелся доступ воздуха, содержащего микроорганизмы, в питательных средах они начинали размножаться. Аналогичным образом Пастер доказал, что порча вина и пива объясняется попаданием в сусло посторонних микроорганизмов или диких дрожжей. Он разработал метод прогревания этих напитков при относительно высокой температуре, что позволило разрушить микроорганизмы порчи и сохранить вкусовые качества напитков. Этот метод получил название пастеризации.
Именно благодаря спонсорской поддержке богатых виноделов и пивоваров Пастер смог продолжать свои дальнейшие научные изыскания.
Далее Пастер пришел к революционному выводу, что болезни человека и животных, как и болезни напитков, вызываются микроорганизмами. Он показал, что каждый микроб вызывает характерное, специфическое для него заболевание. Таким образом Пастером были открыты возбудители куриной холеры, родильной горячки, остеомиелита и газовой гангрены.
В процессе изучения причин инфекционных болезней Пастер сделал еще одно величайшее открытие. Он открыл и разработал метод получения таких микроорганизмов, которые, теряя свою заразность, приобретали способность при введении в организм предохранять его от последующего заражения, т. е. создавать иммунитет. Пастер явился одним из первых биотехнологов и получил вакцины против сибирской язвы и бешенства.

Роберт Кох
Благодарное человечество чтит память Пастера. На средства добровольных пожертвований в 1888 г. в Париже был открыт Пастеровский институт – центр французской бактериологической школы.
Имя Пастера присвоено многим научно-исследовательским институтам в различных странах мира. В России Пастеровский институт открыт в СанктПетербурге.
Прогресс в медицинской микробиологии связан также с именем выдающегося немецкого микробиолога Роберта Коха.
Серией чрезвычайно тщательно подготовленных экспериментов Кох обнаружил и доказал этиологическую роль возбудителей туберкулеза, сибирской язвы и холеры. Он также известен как первооткрыватель плотных питательных сред. Разработанные Кохом методы выделения и культивирования микроорганизмов в лабораторных условиях позволили его ученикам открыть ряд возбудителей инфекционных заболеваний. Не случайно конец ХIX – начало ХХ вв. называют «золотым веком микробиологии». В противовес французской микробиологической школе в Берлине был открыт Институт Коха.
К числу основоположников медицинской микробиологии следует отнести и великого русского «француза» И. И. Мечникова. Этот, по образному выражению Э. Ру, «поэт микробиологии» создал учение о защите организма от чужеродных веществ (инфекционную иммунологию). Кроме того, И. И. Мечников – создатель одного из первых пробиотиков, так называемой «мечниковской простокваши».

Илья Ильич Мечников

Сергей Николаевич Виноградский

Лев Семенович Ценковский
Илье Ильичу поразительно не везло в России. В 1870 г. он не прошел по конкурсу на заведование кафедрой зоологии Медико-хирургической академии. Вакцинируя против сибирской язвы крупное стадо овец одного одесского помещика, И. И. Мечников умудрился погубить все стадо, поэтому в 1882 г. он навсегда покинул Россию и стал работать в институте Пастера в Париже. Тем не менее в 1909 г. И. И. Мечникову была присуждена Нобелевская премия за открытие теории иммунитета. Его учениками были такие всемирно известные микробиологи, как Ж. Борде, А. М. Безредка, Л. А. Тарасевич, П. В. Циклинская, Д. К. Заболотный.
Среди выдающихся деятелей отечественной микробиологии следует назвать имя Л. С. Ценковского, который на основе принципа аттенуации (или ослабления патогенных свойств), разработанного Пастером, получил свой вариант вакцинного штамма возбудителя сибирской язвы, который до сих пор применяется для профилактики этого заболевания у животных. Именно Л. С. Ценковский наметил основные направления изучения микроорганизмов в России. Он способствовал дифференциации микробиологии на ряд самостоятельных дисциплин – общую, медицинскую, ветеринарную, сельскохозяйственную, промышленную и т. д.

Василий Леонидович Омелянский

Даниил Кириллович Заболотный
Выдающуюся роль в становлении и развитии общей микробиологии и микроэкологии сыграл С. Н. Виноградский. Он разработал и внедрил в практику метод избирательных культур, с помощью которого установил значение микроорганизмов в круговороте азота, серы, железа и углерода. С. Н. Виноградский воспитал плеяду выдающихся учеников, среди которых прежде всего следует выделить В. Л. Омелянского, работавшего в области общей и технической микробиологии.
В. Л. Омелянский – автор одного из первых в России руководств «Основы микробиологии». Он исследовал процесс распада клетчатки и экологию почвенных микроорганизмов. При деятельном участии В. Л. Омелянского в 1903 г. было основано «Микробиологическое общество».
Формированию и общему развитию микробиологии в России способствовали также замечательные исследования Н. Ф. Гамалеи. В 1886 г. он организовал первую в России Пастеровскую станцию. Ему принадлежат капитальные труды по изучению бешенства, холеры, туберкулеза. Н. Ф. Гамалея открыл и описал «мечниковский вибрион», названный так в честь именитого друга. Ему также принадлежит идея создания химических вакцин. В честь Н. Ф. Гамалеи был назван Научно-исследовательский институт эпидемиологии и микробиологии Академии медицинских наук.
Выдающимся микробиологом, а впоследствии эпидемиологом был Даниил Кириллович Заболотный, профессор, доктор медицины, академик АН СССР и АН УССР, который создал кафедру микробиологии Военно-медицинской академии. В 1903 г., задолго до открытия возбудителя сифилиса Шаудинном и Гоффманом, он уже демонстрировал бледную трепонему в своих препаратах. В 1909 г. Д. К. Заболотный блестяще защитил докторскую диссертацию «Сифилис, его патогенез и этиология». Научные изыскания выдвинули Д. К. Заболотного в число наиболее авторитетных сифилидологов мира. Впоследствии он занимался проблемами опасных инфекций, впервые доказав природную очаговость чумы и определив роль переносчиков при этой инфекции.

Владимир Дмитриевич Тимаков
Академиком Д. К. Заболотным была создана школа эпидемиологов и микробиологов (Л. В. Громашевский, В. Н. Космодамианский, П. Н. Кашкин).
Третий этап развития микробиологии – современный. Благодаря высокоразвитому техническому оснащению ученые получили возможность детально изучать внутренние структуры микроорганизмов, вмешиваться в процессы их роста и размножения, использовать микроорганизмы в биотехнологических процессах. Выяснилось, что бактерии являются активными продуцентами антибиотиков и других биологически активных соединений – витаминов, аминокислот, стимуляторов роста. В последние годы интенсивно изучаются пробиотики (микроорганизмы, нормализующие микрофлору человека). Все это привело к созданию микробиологической промышленности.
Бурное развитие претерпела иммунология, которая из раздела микробиологии выделилась в самостоятельную медико-биологическую дисциплину. В конце ХХ в. были открыты возбудители новых, ранее неизвестных инфекций – СПИДа, вирусных гепатитов, легионеллеза, болезни Лайма. Наконец, были открыты прионы.

Александр Михайлович Королюк

Владимир Иванович Кочеровец
Создание электронного микроскопа сыграло большую роль в развитии вирусологии и молекулярной биологии. Собственно говоря, современную микробиологию можно назвать молекулярной биологией. На модели бактерий была доказана роль ДНК в передаче наследственной информации. В настоящее время расшифрован геном многих бактерий. Выдающимися учеными-микробиологами, внесшими большой вклад в изучение генетики микроорганизмов, являются В. Д. Тимаков, А. А. Тотолян, А. И. Коротяев и ряд других. Большой вклад в современную микробиологию внесли такие выдающиеся ученые, как О. В. Бухарин, А. А. Воробьев, В. М. Жданов, В. В. Зверев, Э. М. Новгородская, А. А. Смородинцев, Б. Ф. Семенов, А. Н. Маянский, М. П. Чумаков, Л. Я. Эберт и многие другие.
Расшифровка этиологии ранее неизвестной в мире болезни «дальневосточной скарлатиноподобной лихорадки» была проведена в 60-е годы ХХ в. военными микробиологами В. А. Знаменским, Г. П. Сомовым, А. К. Вишняковым и А. М. Королюком.
В. А. Знаменский в опыте самозаражения доказал, что эта болезнь вызывается патогенными микроорганизмами – псевдотуберкулезными иерсиниями.
Александр Михайлович Королюк провел фундаментальные исследования по иммунологии псевдотуберкулеза и кишечного иерсиниоза, впервые разработал серодиагностику этих заболеваний и создал технологические регламенты на диагностические препараты, что обеспечило их производственный выпуск и диагностику иерсиниозов в стране. За этот вклад в науку профессор А. М. Королюк был удостоен Государственной премии СССР (1990 г.). А. М. Королюк является основателем новой научной субдисциплины – пробиотической микробиологии.

Евгений Петрович Сиволодский
Обширные пионерские исследования по микробиологии неклостридиальной анаэробной инфекции в России выполнены Владимиром Ивановичем Кочеровцом, который одним из первых в стране внедрил современную методику исследований при этой инфекции. По данной тематике им опубликован ряд монографий, в том числе знаменитая монография «Анаэробные инфекции в хирургии» (1989) совместно с А. П. Колесовым и А. В. Столбовым. Впоследствии В. И. Кочеровец стал видным ученым-микробиологом, одним из основателей новой научной субдисциплины – фармацевтической микробиологии.
Профессор, доктор медицинских наук Евгений Петрович Сиволодский является одним из выдающихся отечественных ученых в области биохимии и систематики условно-патогенных энтеробактерий и псевдомонад, им были открыты их уникальные таксономические маркеры, уточнено систематическое положение псевдомонад, открыт эскулиноположительный биовар синегнойной палочки. На основе новых научных фактов был разработан микрометод биохимической идентификации энтеробактерий, созданы питательные уникальные среды для ускоренного одноэтапного выделения и идентификации возбудителей раневых и госпитальных инфекций.
Современный этап развития микробиологии характеризуется созданием сети научно-исследовательских институтов микробиологического профиля. Основная заслуга отечественных микробиологов заключается в том, что они не только проводят научные изыскания, но и ведут обширную практическую работу, находясь непосредственно в очагах эпидемий. В настоящее время создана крупная научная школа отечественных микробиологов. Представители этой школы не только успешно работают на ниве отечественного здравоохранения, но и, к сожалению, пополняют ряды американских и европейских ученых.
Глава 2 МОРФОЛОГИЯ МИКРООРГАНИЗМОВ
2.1. Бактерии
Бактерии могут иметь округлую, палочковидную или извитую форму. Круглые бактерии называются кокками (одна клетка – кокк). Слово «кокк» произошло от греческого слова «коккос», что значит «семя». Обычно кокки имеют правильную шарообразную форму. Реже они несколько заострены (пневмококки) или имеют вид кофейных зерен или бобов (гоно-, менингококки).
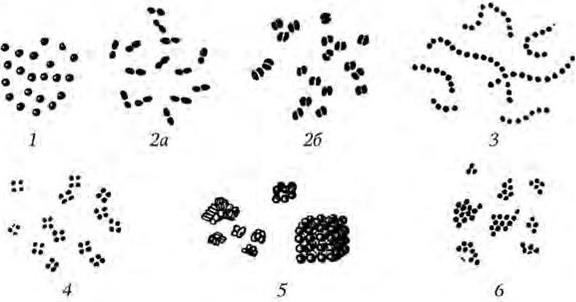
Рис. 1. Формы кокков:
1 – микрококки; 2а – пневмококки; 2б – гонококки; 3 – стрептококки; 4 – тетракокки; 5 – сарцины; 6 – стафилококки
По расположению клеток после деления кокки могут быть подразделены на несколько групп (рис. 1). У некоторых из них после деления клетки расходятся и располагаются поодиночке. Такие формы называются микрококками. Иногда кокки при делении образуют скопления, напоминающие по форме гроздья винограда. Подобные формы называются стафилококками. Другие кокки после деления в одной плоскости остаются связанными парами. Это диплококки (рис. 1: 2а,2б). У стрептококков деление также происходит в одной плоскости, но клетки не отделяются друг от друга, и поэтому образуются различной длины цепочки. Некоторые кокки делятся в трех взаимно перпендикулярных плоскостях, что приводит к образованию своеобразных скоплений кубической формы. Такие скопления кокков называются сарцинами. Если после деления в двух взаимно перпендикулярных плоскостях клетки располагаются в виде сочетаний из четырех кокков, то такие скопления называются тетракокками.
Часто в природе встречаются цилиндрические, или палочковидные, бактерии. После 1875 г., когда немецкий ботаник Кон открыл существование спор, палочковидные бактерии, образующие споры, стали именовать бациллами.
У палочковидных бактерий концы бывают округлыми или заостренными. Разнообразно и расположение клеток после деления – одиночные палочки, по две, цепочками и т. п. (рис. 2).

Рис. 2. Различные формы палочковидных бактерий

Рис. 3. Извитые формы бактерий
Нередко встречаются извитые, или спиральные, бактерии. Медицинское значение имеют боррелии, трепонемы и лептоспиры, имеющие форму длинных изогнутых (несколько завитков) палочек, и вибрионы, представляющие лишь часть витка спирали и похожие на запятую (рис. 3).
Бактериальные клетки очень малы, их размеры исчисляются микрометрами (мкм). Кокки имеют диаметр около 0,5 – 1,0 мкм. Ширина палочковидных форм бактерий составляет от 0,5 до 1,0 мкм, а длина может достигать нескольких десятков микрометров. Размер бактерий может значительно изменяться в зависимости от температуры, состава среды и т. д.
Бактериальная клетка (рис. 4) окружена оболочкой. В цитоплазме содержатся ядерный аппарат, вакуоли, аналоги митохондрий – рибосомы, а также различного рода включения, обычно образующиеся в процессе обмена веществ.
Клеточная оболочка обладает определенной ригидностью (жесткостью) и вместе с тем эластичностью и способностью изгибаться. Клеточную оболочку можно разрушить ультразвуком, ферментом лизоцимом, тонкой иглой и т. д. При этом содержимое клетки – цитоплазма – с ее включениями вытекает и приобретает шаровидную форму. Отсюда следует, что оболочка придает бактериальной клетке определенную форму.

Рис. 4. Строение бактериальной клетки:
1 – капсула; 2 – клеточная оболочка; 3 – клеточная перегородка; 4 – жгутики; 5 – цитоплазматическая мембрана; 6 – нуклеоид; 7 – рибосомы; 8 – включения; 9 – плазмиды; 10 – споры (по: Пяткин К. Д. и Кривошеин Ю. С., 1980)
Внешняя оболочка (клеточная стенка) может быть удалена без повреждения протоплазмы. Полученная структура, окруженная лишь цитоплазматической мембраной, в слабо гипотонической среде принимает форму шара. Она была названа протопластом. Структуры, в которых стенка удалена неполностью или есть сомнения в ее полном отсутствии, принято называть сферопластами.
Масса клеточной оболочки составляет около 20 % от массы клетки. Клеточная оболочка часто бывает окружена слизистым слоем, который различается у отдельных бактерий как по толщине, так и по консистенции. Этот слой называется капсулой.
Капсула защищает клетку от неблагоприятных воздействий окружающей среды. Бактерии, окруженные капсулами, могут жить в такой среде, в которой рост некапсулированных бактерий ограничен. В некоторых случаях вещество капсулы может использоваться бактериями как пищевой резерв при отсутствии другой пищи.
К клеточной оболочке бактериальной клетки тесно прилегает внешний слой цитоплазмы — цитоплазматическая мембрана. Это мягкое образование, иногда называемое осмотическим барьером клетки, действует как полупроницаемая мембрана и контролирует транспорт ионов и молекул в клетку и из клетки. Цитоплазматическая мембрана составляет около 10 % от сухой массы клетки, состоит из полипротеидов и содержит до 75 % липидов клетки. Толщина мембраны не превышает 50 – 100 0. Электронная микроскопия ультратонких срезов бактерий показала, что цитоплазматическая мембрана состоит из трех слоев бимолекулярного листка липида, поверхности которого выложены монослоями белка. Нередко мембрана дает внутрицитоплазматические ответвления (инвагинации), приводящие к образованию особых телец — мезосом.
Мембрана и мезосомы выполняют функции, свойственные митохондриям высших организмов, в которых локализованы разнообразные ферментные системы.
Под цитоплазматической мембраной находится цитоплазма. Она обычно рассматривается как коллоидная система, состоящая из воды, белков, жиров, углеводов, минеральных соединений и других веществ, соотношение которых зависит от вида бактерий и их возраста.
Детальные исследования микромолекулярной организации и субмикроскопической структуры цитоплазмы выявили ее микрогранулярный характер. Микрогранулярная структура цитоплазмы представлена цитоплазматическими гранулами диаметром 100 – 200 0. Многие из этих гранул являются рибосомами – частицами с богатым содержанием белка и рибонуклеиновой кислоты. В бактериальной клетке содержится приблизительно до 10 000 рибосом, осуществляющих синтез белков в бактериальной клетке.
В цитоплазме бактерий имеются гранулы запасных питательных веществ. В качестве резервных питательных веществ в клетках бактерий могут накапливаться вещества, состоящие из углеводов – гликогена (животного крахмала) или гранулезы (близкой к крахмалу). При недостаточном поступлении углеродсодержащих веществ в среду гликоген или гранулеза постепенно исчезают из клеток бактерий.
У некоторых видов бактерий в клетках накапливаются жир и волютин. Последний состоит из неорганических полифосфатов и полиметафосфатов, а также веществ, близких к нуклеиновым кислотам. Волютин обнаруживается в виде крупных, хорошо видимых гранул, образующихся в больших количествах на средах, богатых глицерином или углеводами.
В цитоплазме бактериальных клеток расположен ядерный аппарат (иногда называемый нуклеоидом). Это образование также называют генофором, или бактериальной хромосомой. По сути дела это двойная, замкнутая в кольцо суперспирализованная молекула ДНК. Обычно ядерное образование (по одному на клетку) располагается в центральной части внутреннего содержимого клетки бактерий. В отличие от клеток высокоорганизованных организмов нуклеоиды бактерий не отделены от цитоплазмы мембраной.
Часть бактерий способна к активному передвижению. Существует два типа подвижных бактерий: ползающие и плавающие. Ползающее движение наблюдается у миксобактерий. Эти организмы могут совершать скользящие движения по поверхности в результате волнообразных сокращений, вызывающих периодическое изменение формы клетки.
Многие бактерии передвигаются с помощью особых нитевидных придатков — жгутиков, обусловливающих их подвижность благодаря своим спиральным волнообразным движениям вследствие ритмичных сокращений (рис. 5, см. цв. вклейку).
Кокки, за исключением отдельных видов, не имеют жгутиков. Среди бактерий цилиндрических форм приблизительно около половины имеют жгутики. Большинство спиралевидных бактерий подвижны.
Бактерии с одним жгутиком называются монотрихами, имеющие на одном или на обоих концах тела пучок жгутиков — лофотрихами. Перитрихами называются бактерии, имеющие жгутики по всей поверхности тела. Количество жгутиков у различных видов бактерий различно. Например, вибрионы имеют 1 – 3 жгутика, а у палочковидных бактерий обнаружено от 50 до 100 жгутиков.
Толщина жгутиков – около 0,01 мкм, а длина их во много раз превосходит длину тела бактерий. В химическом отношении жгутики представляют собой белок флагеллин и денатурируются при нагревании.
Жгутики не являются жизненно важной структурой для бактериальной клетки. Так, бактерии, обладающие жгутиками, можно вырастить в таких условиях, при которых жгутики не развиваются. У подвижных бактерий наблюдаются «фазовые вариации», т. е. жгутики присутствуют в течение одной фазы развития и отсутствуют в другой. Жгутики бактерий можно разрушить, при этом клетка будет оставаться жизнеспособной.
Свое начало жгутики берут от плотного тельца в цитоплазме, но прикрепляются они не только к цитоплазматической мембране, но и к клеточной. Протопласты, освобожденные от клеточной оболочки, сохраняют жгутики.
Бактериальные клетки (монотрихи), перемещаясь с помощью жгутика вдоль своей оси, совершают волнообразное движение. У перитрихов наблюдается оживленное кувыркание.
Скорость движения бактериальных клеток зависит от особенностей их аппарата движения и свойств среды – ее вязкости, температуры, рН, осмотического давления и др. Некоторые бактерии могут передвигаться при благоприятных условиях на расстояние, превышающее размеры клетки в 10 – 15 раз. Большинство же бактерий за секунду проходит расстояние, равное размеру их клетки.
Кроме жгутиков клетки бактерий могут иметь прямые отростки — фимбрии. Фимбрии значительно короче и тоньше жгутиков, но более многочисленны и обнаружены как у подвижных, так и у неподвижных организмов.
Некоторые бактерии способны образовывать споры (эндоспоры), тельца сферической или эллиптической формы, очень устойчивые к неблагоприятным условиям. Споры преломляют свет и четко видны в световом микроскопе (рис. 6). Обычно в клетке образуется одна спора — эндоспора. Споры не являются органами размножения, они служат для приспособления организма к неблагоприятным внешним условиям.

Рис. 6. Споры B. anthracis (по: Мотавкина Н. С. и Артемкин В. Д., 1976)
Формирование спор зависит от условий их роста. Споры могут оставаться живыми в условиях, когда вегетативные клетки, не образовавшие спор, погибают. Большинство спор хорошо переносят высушивание, многие из них остаются жизнеспособными даже при кипячении в течение нескольких часов. В сухом состоянии споры погибают лишь при сильном нагревании (150 – 160 °C) в течение нескольких часов.
Споры отдельных видов бактерий могут сохраняться веками.
Оболочка спор содержит мукопротеиды. Под слоями внешней оболочки лежит так называемая кора споры, которая служит барьером против проникновения воды и растворенных в ней веществ. Под корой расположена стенка споры, покрывающая цитоплазму, ядро и резервный материал. Цитоплазма споры имеет гомогенную структуру.
В спорах содержится мало воды (вследствие обезвоживания), что предохраняет белки от денатурации при высоких температурах. Общая схема спорообразования может быть представлена в следующем виде. В вегетативной клетке возникают уплотненные зоны цитоплазмы, носящие название первичной споры, или проспоры,которые, сливаясь, преломляют свет. Проспора окружена цитоплазматической мембраной. Дальнейшее развитие споры состоит в образовании оболочек и ее созревании.
Диаметр споры равен приблизительно диаметру клетки, в которой она образовалась, или несколько превышает его. У некоторых бактерий спора формируется на конце клетки, которая при этом несколько расширяется и приобретает вид барабанной палочки. У других бактерий спора образуется в центре клетки, которая либо не меняет формы (род Bacillus), либо в середине расширяется и принимает вид веретена (род Clostridium). Вегетативная часть клетки разрушается и исчезает, и остается только преломляющая свет спора, с трудом подвергающаяся окрашиванию.
Попадая в благоприятные условия, спора начинает «прорастать». При этом она разбухает не только в результате поглощения воды, но и вследствие роста клетки за счет резервного материала. Затем оболочки под влиянием давления, вызванного ростом, разрываются и дают трещину. Возникает новая вегетативная клетка. Способ, которым клетка выходит из споры, индивидуален для каждого вида и может использоваться в качестве видовой характеристики.
Благодаря жесткости стенки клетка сохраняет форму: шаровидную, палочковидную или извитую. Оболочка защищает клетку, сохраняя ее структурную целостность при изменении внешних условий, в частности при осмотических воздействиях. Наряду с мембраной она служит полупроницаемым барьером, обеспечивающим избирательное проникновение питательных веществ из окружающей среды и выделение высокомолекулярных соединений – токсинов или ферментов, участвующих во внеклеточном переваривании субстратов. Клеточная стенка определяет антигенную специфичность видов, является местом адсорбции фагов на клетке и участвует в процессах движения и деления.
При изучении химического состава клеточных стенок грамположительных (бактерий с толстой клеточной стенкой) и грамотрицательных бактерий (с тонкой клеточной стенкой) выявились существенные различия в их качественном и количественном составе (рис. 7).

Рис. 7. Клеточная стенка грамотрицательных бактерий (А) и грамположительных (Б) (по: Поздеев О. К., 2001)
За механическую прочность стенки у этих групп микроорганизмов ответствен один и тот же гетерополимер — пептидогликан, вместе с тем его количественное содержание и локализация у разных бактерий не одинаковы. А такой компонент клеточной стенки, как тейхоевые кислоты, содержится в стенках только грамположительных бактерий. Электронномикроскопическое изучение срезов поверхностных слоев грамположительных и грамотрицательных бактерий также подтвердило неоднородность структуры их клеточных стенок.
Стенка грамположительных бактерий представляет собой однородную структуру толщиной приблизительно 20 – 80 нм. Главный ее компонент – пептидогликан – составляет 40 – 90 % от сухой массы стенки. Это универсальный гетерополимер. С ним ковалентно связаны полисахариды и тейхоевые кислоты. Он найден в клеточных стенках почти всех прокариотических клеток.
Жесткий слой пептидогликана окружает всю бактериальную клетку и является по существу одной крупной «мешковидной» молекулой. Молекула пептидогликана представляет собой параллельные полисахаридные цепи, связанные между собой короткими пептидными мостиками. Повторяющейся единицей полисахаридных цепей является муропептид. Таким образом, молекула пептидогликана – это замкнутая со всех сторон сеть, окружающая бактериальную клетку.
Структура пептидогликанового слоя обусловливает основные функции клеточной стенки – формообразующую и защитную.
Пептидогликан в клеточных стенках грамположительных бактерий ковалентно связан с полисахаридами особого типа – тейхоевыми кислотами. Эти растворимые в воде полимеры представляют собой длинные цепи, состоящие из остатков глицерина и рибита, связанных друг с другом фосфодиэфирными мостиками. Эти соединения могут составлять до 50 % массы сухих стенок. Из клеточных стенок бактерий были выделены два типа тейхоевых кислот: рибиттейхоевая, состоящая из остатков рибитфосфата, и глицеринтейхоевая, состоящая из остатков глицерофосфата. Небольшое количество глицеринтейхоевой кислоты ковалентно связано с мембранными гликолипидами. Это соединение называют липотейхоевой, или мембранной тейхоевой, кислотой. Клеточные стенки каждого штамма содержат кислоту только одного типа.
Значительная часть тейхоевых кислот располагается между клеточной мембраной и слоем пептидогликана. Связь тейхоевых кислот с пептидогликаном осуществляется путем образования фосфодиэфирной связи. Выступая на поверхности клетки, тейхоевые кислоты создают в ее оболочке высокую плотность регулярно ориентированных зарядов, способствуя проникновению ионов через внешние слои.
Кроме пептидогликана и тейхоевых кислот клеточные стенки грамположительных бактерий содержат также сопутствующие полисахариды – гликозамин, глюкозу, арабинозу, маннозу и (или) рамнозу. Тейхоевые кислоты и полисахариды клеточных стенок обладают антигенной активностью.
Липиды в стенках грамположительных бактерий содержатся в очень небольшом количестве или отсутствуют вовсе. В основном это длинноцепочечные жирные кислоты, соединенные сложноэфирными связями с полисахаридами стенки. Белки в клеточных стенках этой группы бактерий содержатся не всегда. Если они обнаруживаются, то связаны с внешней мембраной.
Клеточная стенка грамотрицательных бактерий устроена сложнее, чем грамположительных. Она состоит из трех слоев: наружного – липопротеинового, среднего – липополисахаридного и внутреннего – пептидогликанового (ригидного).
Внутренний пептидогликановый слой тонкий (2 – 3 нм). Его содержание в клеточной стенке невелико – всего 5 – 10 % от массы сухого вещества стенки. Грамотрицательные бактерии пептидогликана отличаются от грамположительных низким содержанием поперечных сшивок и меньшим разнообразием диаминокислот. Пептидогликановый слой стенки может быть выделен в виде очень тонкого мешочка, сохраняющего форму и размеры исходной клетки.
Поверх тонкого пептидогликанового мешка располагается более толстый слой (8 – 10 нм), состоящий из липополисахаридов, белков и фосфолипидов, тонкая структура которого мало отличается от цитоплазматической мембраны.
Липополисахариды – главные компоненты внешнего слоя стенки. Они представляют собой сложную молекулу – «скелет» (липид А) и прикрепленный к нему полисахарид, образованный ядром и терминальной цепью повторяющихся единиц. У всех грамотрицательных бактерий ядро полисахарида имеет одинаковую структуру. Вариабельной частью являются повторяющиеся единицы – трисахариды либо разветвляющиеся тетра- или пентасахариды. Эти длинные боковые цепи выступают над поверхностью клетки, образуя так называемый «молекулярный ворс», и служат рецепторами для адсорбции многих фагов. Липополисахариды являются главными антигенными детерминантами клеточной стенки грамотрицательных бактерий.
Риккетсии – полиморфные грамотрицательные бактерии (рис. 8, см. цв. вклейку). Термин «риккетсия» впервые применил длиной до в 1916 г. бразильский микробиолог Э. да Роха-Лима в память Г. Риккетса, который, изучая сыпной тиф, заразился и трагически погиб. Большой вклад в изучение риккетсий внесли отечественные ученые: О. О. Мочутковский, П. Ф. Здродовский, Е. М. Голиневич и К. Н. Токаревич. По морфологическим признакам выделяют несколько форм риккетсий:
1) кокковидные – овал или эллипсоид диаметром 0,5 мкм, возможно образование диплоформ (гантелей), цепочек, конгломератов, в ряде случаев обнаруживается зернистость;
2) палочковидные образования длиной до 1 – 1,5 мкм с зернистостью на концах;
3) удлиненные, изогнутые, тонкие образования 3 – 4 мкм;
4) нитевидные (мицеллярные) формы длиной 10 – 40 мкм и более, иногда это зернистые изогнутые нити.
Доказана способность риккетсий образовывать фильтрующиеся формы. Риккетсии не образуют спор, имеют микрокапсулу, не обладают подвижностью.
Исследование риккетсий с применением электронной микроскопии и цитохимических методов показало, что микроорганизмы имеют две оболочки – внешнюю (выполняет функции клеточной стенки, состоит из трех слоев) и внутреннюю (толщиной 6 нм). В цитоплазме обнаружены гранулы величиной 20 – 70 нм и вакуоли диаметром 6 – 8 нм.
Риккетсии размножаются в эндотелиальных клетках капилляров, что приводит к закупорке сосудов и появлению сыпи.
Для риккетсий характерно большое содержание нуклеиновых кислот – как ДНК, так и РНК, что сближает их с бактериями. В теле риккетсий обнаружено большое количество липидов и мало углеводов, что характерно для вирусов.
Во внешней среде риккетсии малоустойчивы и сохраняются в организме членистоногих – клещей, блох и вшей. Исключением является возбудитель ку-лихорадки, который при низких температурах сохраняется во внешней среде около года.
Риккетсии являются внутриклеточными паразитами, поэтому не способны расти и размножаться на бесклеточных средах и мертвых тканевых субстратах. Особенностью риккетсий является их оптимальное размножение в живых тканях и клетках при температуре 35…36 °C. Однако уже при 40 °C рост и размножение риккетсий угнетается.

Рис. 9. Электронная микрофотография микоплазм
Особенности внутриклеточного паразитизма риккетсий следует рассматривать, исходя из места их локализации в инфицированной клетке. Некоторые риккетсии размножаются в цитоплазме (возбудители эпидемического и эндемического сыпных тифов и ку-лихорадки). Риккетсии – возбудители клещевых лихорадок – размножаются и в цитоплазме, и в ядре.
Микоплазмы – мелкие самореплицирующиеся грамотрицательные бактерии (прокариоты). Название «микоплазмы» было предложено в 1929 г. К. Новаком, оно подчеркивало их пластичность.
Микоплазмы относятся к классу Mollicutes («мягкокожие»).
При световой микроскопии в окрашенном по методу Романовского – Гимзы препарате видны полиморфные клетки – глобулы различной величины, зерна, иногда нити. При фазовоконтрастной микроскопии определяется гетерогенность популяции не только по величине, но и по оптической плотности отдельных клеток. Диаметр клеток 0,3 – 0,8 мкм (рис. 9). Иногда грушевидные, гантелевидные, ветвящиеся формы могут достигать 100 – 150 мкм либо встречаются в виде элементарных телец – гранул размером всего 0,1 – 0,25 мкм.
Такая полиморфность обусловлена отсутствием клеточной стенки, что качественно отличает их от остальных бактерий. Вместо клеточной стенки микоплазмы покрыты трехслойной цитоплазматической мембраной.
У бактерий под влиянием неблагоприятных факторов внешней среды (при применении антибиотиков, действующих на клеточную стенку) может возникать обратимое состояние L-формы. Клетка микоплазм очень просто организована, она содержит минимальное количество органелл: цитоплазму, рибосомы, циркулярную двунитчатую ДНК, мембранные внутриплазматические структуры и дополнительные органоиды. Мембрана составляет 15 % от массы всей клетки. На ее наружном слое выявляется капсулоподобный слой из полисахаридов. Он играет защитную и адсорбционную роль. Толщина капсулы 20 – 125 нм.
Цитоплазма содержит протеины, липиды, углеводы, РНК и ДНК.
Из дополнительных органелл выделяют сеть фибрилл, расположенных под цитоплазматической мембраной и прикрепленных к ее внутреннему слою. Эти белки выполняют функцию цитоскелета. Есть микроворсинки и терминальные структуры на одном из полюсов клетки – нити с заостренными концами длиной в клетку микоплазмы, которые обеспечивают некоторую скользящую подвижность и адгезию.
Полиморфизм тесно связан с репродукцией микоплазм. Для них характерно как равновеликое, так и неравномерное деление материнской клетки. Возможно также сегментирование цитоплазмы на несколько клеток с образованием в итоге мицеллярной структуры, из которой затем формируются сферические тела.
Новые особи могут возникать и в результате отпочковывания их от поверхности материнской клетки.
Жизненный цикл и метаболизм микоплазм зависит от клетки-хозяина, с которой они тесно связаны. Они персистируют и паразитируют на мембранах эукариотических клеток. Отдельные виды приобрели тропизм к определенной ткани.
Микоплазмы высокоустойчивы к действию низких температур. При температуре от –20 до –65 °C большинство бульонных культур сохраняют жизнеспособность в течение 12 мес., при температуре 4 °C – около 1,5 мес. Применение 50 %-ного глицерина в питательной среде резко увеличивает сроки их жизнеспособности. Устойчивость микоплазм к более высоким температурам зависит от состава среды, в которой они находятся. В средах с повышенным содержанием белка их устойчивость возрастает.
Микоплазмы чувствительны к изменению рН среды в щелочную сторону. При рН > 7,5 их жизнедеятельность резко угнетается.
Хламидии – мелкие грамотрицательные кокковидные микроорганизмы размером 0,25 – 1 мкм. По своим основным признакам они отнесены к бактериям, так как содержат два типа нуклеиновых кислот (ДНК и РНК), рибосомы, мурамовую кислоту (компонент клеточной стенки грамотрицательных бактерий), размножаются бинарным делением и даже чувствительны к некоторым антибиотикам. Ранее хламидии относили к крупным вирусам. В отличие от бактерий они не растут на искусственных питательных средах, их культивируют в желточном мешке куриных эмбрионов и тканевых культурах так же, как и вирусы. Кроме того, хламидии являются строгими внутриклеточными паразитами и размножаются в основном в цитоплазме клеток человека. Хламидии помещены в одну таксономическую группу с риккетсиями, с которыми их объединяет внутриклеточный паразитизм.
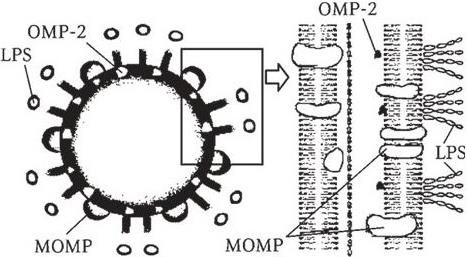
Рис. 10. Структура клеточной стенки хламидий
Структура клеточной стенки хламидий соответствует общему принципу построения грамотрицательных бактерий (рис. 10). Она состоит из внутренней цитоплазматической и наружной мембран (обе являются двойными, обеспечивая прочность клеточной стенки). Антигенные свойства хламидий определяются внутренней мембраной, которая представлена липополисахаридами (LPS). В нее интегрированы так называемые белки наружной мембраны (Outer membrane proteins – OMP). На основной белок наружной мембраны – Maior Outer Membrane Protein (МОМР – элементарное тельце) приходится 60 % от общего количества белка. Оставшаяся антигенная структура представлена белками наружной мембраны второго типа – ОМР-2.
Длительное время считалось, что хламидии имеют характерный дефект ряда ферментных систем и не способны самостоятельно окислять глутамин и пируват, а также осуществлять фосфорилирование и эффективное окисление глюкозы. Ранее также предполагалось, что хламидии являются облигатными внутриклеточными энергетическими паразитами, использующими метаболическую энергию эукариотической клетки в виде АТФ и других макроэргических соединений. В настоящее время анализ генома показал, что хламидии способны синтезировать АТФ, хотя и в незначительных количествах, путем гликолиза и расщепления гликогена. У хламидий отсутствует пептидогликан – компонент клеточной стенки, существующий как у грамположительных, так и у грамотрицательных бактерий, но при этом в геноме содержатся гены, кодирующие белки, которые необходимы для его полного синтеза. Предполагается, что синтезируемые пептидогликан или пептидогликановый компонент имеют функции, отличные от функций других бактерий.
Методом сканирующей электронной микроскопии на поверхности хламидий были выявлены куполообразные структуры, пронизанные микрофиламентами. Функцию этой структуры связывают с транспортом питательных веществ от эукариотической клетки к паразиту. Обнаружение в геноме хламидий генов, кодирующих аппарат для III типа секреции, который обусловливает вирулентность грамотрицательных бактерий, позволило предположить, что это образование осуществляет передачу сигнала от паразита к эукариотической клетке.
2.2. Грибы
В отличие от бактерий грибы являются эукариотами. Это – гетеротрофные, одно- или многоклеточные организмы, составляющие особое царство живых организмов — Mycota.
Все грибы, за немногим исключением, имеют мицелиальное строение. Мицелий — это совокупность гифов (разветвленных нитей) гриба, из которых состоит его тело — таллом. Мицелий может быть либо одноклеточным, либо разделен перегородками (септами), т. е. многоклеточным. Грибы, имеющие слаборазвитый, несептированный мицелий, относятся к низшим. Таллом, состоящий из почкующихся или делящихся клеток, характерен для дрожжей. Дрожжи могут образовывать мицелиальные структуры, однако такой мицелий отличается от истинного, так как возникает в результате почкования, а не апикального роста гифов, и называется ложным, или псевдомицелием. Почкование присуще и некоторым мицелиальным грибам. Грибы, способные наряду с мицелием образовывать почкующиеся клетки, называются диморфными.
Клетка грибного мицелия всегда одета ригидной 4-слойной оболочкой (наружный глюкановый слой, глюкопротеидный, белковый и внутренний хитиновый). В наружных частях клеточной стенки нередко откладываются пигменты – меланины. Цитоплазматическая мембрана в качестве основных стероидов включает эргостерин и зимэстерол. Цитоплазма содержит эндоплазматическую сеть, аппарат Гольджи, митохондрии, рибосомы, лизосомы, ломосомы, вакуоли. Ядро у грибной клетки имеет четкие границы, определяемые двойной мембраной. Оно содержит ядрышко и хромосомы, которые состоят из ДНК и гистонов. Число гаплоидных хромосом у грибов никогда не бывает меньше 2 (3 – 28, а чаще 8). Грибная клетка часто бывает многоядерной.
По характеру роста мицелий грибов разделяют на субстратный (вегетативный) и воздушный (репродуктивный). Разновидностью субстратных гифов у паразитических грибов-дерматофитов являются инфекционные гифы, которые выполняют несколько функций: прикрепление к субстрату, внедрение в него (в кожу, волосы, ногти) и поглощение питательных веществ.
В отличие от растений грибы не содержат фотосинтезирующих пигментов. Этим аэробным организмам для роста требуется содержание в питательной среде углеродсодержащих и азотсодержащих компонентов, минеральных веществ, витаминов и др. Поверхностный и внутрисубстратный рост грибов обусловлен их способностью поглощать питательные вещества путем абсорбции. Развитая система гифов обеспечивает большую площадь поглощения. Оптимальная температура роста грибов составляет 28 – 30 °C (для патогенных – 37 °C и выше). Оптимум рН – 5,8 – 6,5. Однако грибы могут расти и в диапазоне температур от 0 до 60 °C.
2.3. Вирусы
Вирусы – уникальные микроорганизмы, расположенные на границе жизни, отличительными признаками которых являются обязательный паразитизм на генетическом аппарате живых клеток (растений, бактерий, насекомых, животных) и наличие в геноме нуклеиновой кислоты только одного типа. Вирусами поражены все формы жизни от растений и бактерий до человека. Способность вирусов вносить новую информацию в генетический аппарат клетки-хозяина определяет их роль как важнейшего фактора изменчивости и биологической эволюции всего живого. Наконец, с вирусами связывают возникновение опухолей, атеросклероза, диабета, разнообразных нервно-психических заболеваний и другой инфекционной патологии.
Вирусы как элементарная единица жизни – идеальный объект для молекулярных биологов и генетиков. Не случайно на вирусах сделаны величайшие биологические открытия ХХ в. – расшифровки генетического кода и механизма синтеза белка и нуклеиновых кислот. Многие опухоли животных индуцированы вирусами. В 1960-х гг. Л. А. Зильбером (1894 – 1966) впервые была выдвинута вирусогенетическая теория происхождения опухолей человека, и сейчас вирусологи активно включились в изучение их природы.
В последние десятилетия на фоне существенного снижения эпидемических бактериальных инфекций резко возрос удельный вес вирусных инфекционных заболеваний человека (до 80 % всей инфекционной заболеваемости). Грипп, аденовирусные инфекции, вирусные гепатиты и другие инфекции вирусной природы продолжают наносить большой ущерб здоровью людей. Существует немало опасных вирусов, которые могут использоваться в качестве весьма эффективного средства ведения биологической войны.
Вирусы – автономные генетические структуры, способные функциoнировать и репродуцироваться в восприимчивых к ним клетках (растений, бактерий, грибов, простейших, животных и человека), используя их генетический и белоксинтезирующий аппарат.

Дмитрий Иосифович Ивановский
Основоположником вирусологии является российский ученый, петербуржец Дмитрий Иосифович Ивановский (1864 – 1920), открывший на рубеже XIX – XX вв. уникальный мир вирусов. Еще будучи студентом, он приступил к изучению мозаичной болезни табака, которая наносила колоссальный экономический ущерб табакопроизводству. Пропуская через бактериальные фильтры Шамберлана сок из пораженных листьев, он установил, что данную болезнь вызывает мельчайший микроорганизм, который проходит через фильтр и способен вызывать заболевание при искусственном заражении. В своей диссертации (1888) он описал это заразное заболевание табака и указал, что возбудитель гораздо мельче бактерий, имеет корпускулярную природу и невидим в обычном световом микроскопе. В 1892 г. Д. И. Ивановский опубликовал материалы своих опытов, поэтому возникновение вирусологии ведет свой отсчет с этого времени.
Существует несколько гипотез происхождения вирусов.
1. Вирусы – потомки доклеточных форм жизни. Данная гипотеза основана на многообразии способов хранения генетической информации у вирусов. Различают 7 типов строения ДНК и 5 типов строения РНК-вирусов. Природа как бы отрабатывала на модели вирусов различные способы записи и сохранения генетической информации, отобрав для других живых структур наиболее надежную, двунитевую ДНК.
2. Вирусы являются результатом регрессивной эволюции одноклеточных организмов в процессе углубления паразитизма. Потомки внутриклеточных паразитировавших бактерий постепенно теряли те или иные атрибуты клетки, которые были не нужны при нахождении внутри клетки-хозяина.
3. Вирусы произошли от определенных клеточных генов, которые приобрели способность покидать клетку, но сохранили свойство относительно легко в нее возвращаться. Этой гипотезой, в частности, объясняется слабость и несвоевременность иммунного ответа организма человека на внедрение многих вирусов.
Вирусы – это форма жизни, которой присущи своеобразные атрибуты:
• способность к самовоспроизведению;
• способность передавать потомкам основные свойства – наследственность (отмечается консерватизм наследственности у возбудителя оспы и, наоборот, большая изменчивость у возбудителя гриппа и вирусов иммунодефицита человека);
• генетическая изменчивость; мутации генов вируса гриппа А происходят в миллион раз быстрее, чем в клетках, в котоклеточных рых они паразитируют; быстрому изменению подвержены поверхностные структуры вируса – гемагглютинины и нейраминидаза; иммунная система человека не успевает за этими изменениями, вот почему даже при наличии массы противогриппозных вакцин управлять данной инфекцией человек еще не научился; поверхностные структуры ВИЧ изменяются в 100 – 1000 раз быстрее, чем вирус гриппа, что осложняет создание надежных вакцин против «чумы ХХ века»;
• адаптация к определенной экологической нише, к определенному хозяину (растению, бактериям, грибам, простейшим, насекомым, земноводным, теплокровным животным и человеку); отдельные группы вирусов циркулируют со сменой хозяев, это полигостальные вирусы («рожденные» членистоногими – арбовирусы), размножающиеся в организме насекомых и животных; другие вирусы относятся к моногостальным и имеют узкий круг хозяев (бактериофаги);
• способность вызывать инфекцию, размножаться в клетке хозяина (проникает внутрь чувствительной клетки одна вирусная частица, а выходит из нее 100 – 1000 новых вирусных частиц); вирусы чаще вызывают персистентные инфекции (носительство), реже – заболевания, приводящие к гибели хозяина;
• функционирование вирусного генома по общим законам генетического кода.
Несмотря на то что вирусы относятся к представителям живого, их нельзя назвать организмами. Вирусы имеют ряд принципиальных отличий от других живых систем:
• малые размеры;
• очень простое строение вириона – геном, состоящий из ДНК или РНК, и капсид (белковая оболочка);
• отсутствие клеточного строения (цитоплазмы, мембран, рибосом);
• наличие у вируса только одного вида нуклеиновых кислот – ДНК или РНК, по этому принципу вирусы разделены на два подцарства;
• отсутствие способности к росту и бинарному делению;
• паразитизм на молекулярном (генетическом) уровне, в клетку проникает только геном вируса и полностью подчиняет ее своим интересам;
• способность к интеграции собственного генома с геномом клетки;
• невозможность существовать без клетки хозяина, так как репродукция возможна только в клетке хозяина.
Размеры вирусов определяются косвенно на микрофотографиях, микрофильтрацией либо ультрацентрифугированием. Вирус, находящийся вне клетки, называется вирионом.
Фотографирование осуществляется в электронном микроскопе. Однако, в связи с тем что вирусы прозрачны для электронов, препараты готовят специальным способом. Создают подложку из чистого углерода либо коллодия, на нее наносят вирионы в испаряющейся жидкости и проводят лиофильную сушку. На материал на подложке методом напыления под углом наносят тяжелые металлы (палладий, уран). Другим способом контрастирования является метод реплик – вируссодержащий материал, очищенный от балластных белков, заливают тонким слоем пластмассы. После высыхания образуется рельефная матрица, которую просматривают в электронном микроскопе. Негативное контрастирование можно осуществить путем помещения материала на подложку и добавления нейтрального раствора фосфовольфрамовой кислоты или урацилацетата, затекающего во все углубления вириона и создающего для электронов непроницаемый фон, на котором видны детали строения вирусных частиц.
Масса вирионов определяется косвенно при ультрацентрифугировании в единицах Сведберга.
Размеры вирусов колеблются от 20 нм у самых мелких до 350 – 400 нм (у вирусов семейства Poxviridae)(1нм=10– 9 м). Колебания размеров вирусов измеряют на микрофотографиях.
Размеры частиц можно определять при их фильтрации через заведомо известные диаметры фильтров. Крупные вирионы (тельца Пашена при оспе) можно видеть и в световой микроскоп в виде мелких точек.
Морфология вирусов учитывается при их классификации. Основной компонент вириона – белковая оболочка (капсид), содержащая нуклеиновую кислоту. Капсиды состоят из белковых субъединиц (капсомеров). Каждый капсомер – молекула белка с определенной молекулярной массой одного или разных видов белков. Например, у вируса табачной мозаики 2130 одинаковых капсомеров. Капсид включает пространство cor, у многих вирусов помимо нуклеиновой кислоты есть еще специальные ферменты. Состав белков и ферментов может быть различным: у вируса герпеса – 32 белка, у вируса оспы – 12 ферментов. Есть вирусы всего с 1 – 2 ферментами. Ферменты играют важную роль в репродукции вирусов.
По типу строения вирионов выделяют: спиральный тип симметрии (рабдовирусы, вирусы гриппа, парагриппа, коронавирусы); квазисферический – кубический, или икосаэдральный, тип симметрии; cмешанный – у Т-четных бактериофагов (головка в виде многогранника, а хвост в виде спирали).
У вируса табачной мозаики – спиральный тип симметрии вириона. Белковый чехол состоит из отдельных субъединиц в виде шестигранников. Капсомеры – белковые субъединицы, на внутренней поверхности которых расположен желобок, где находится спиралевидная РНК. Капсомеры идентичны друг другу: один и тот же белок, повторяющиеся белковые молекулы (экономится генетический материал). Диаметр капсида 15 – 18 нм, длина вириона до 300 нм (вид палочки). Капсид имеет жесткую структуру.
Тип симметрии определяется только нуклеокапсидом, суперкапсид при этом не учитывается. Например, вирус гриппа снаружи выглядит как сфера, нуклеокапсид имеет спиральный тип симметрии.
Икосаэдр – многогранник, состоящий из 12 вершин и 20 ребер. К данному типу симметрии относятся аденовирусы человека и животных. Капсомеры могут иметь разное строение и содержать разные белки. У аденовирусов боковые капсомеры в виде гексонов, а вершинные – пентонов (соседствуют с пятью капсомерами). От пентамеров отходят выросты (фибры). Это прикрепительные белки. Икосаэдр обеспечивает прочность капсида (защиту от внешних факторов), а прочная связь между капсомерами – минимум свободной энергии.
Многие вирусы имеют суперкапсид – дополнительную оболочку сложно устроенных вирусов, или пеплос. Структурные элементы суперкапсида – шипики, или пепломеры. У вируса гриппа их два типа: гемагглютинины и нейраминидаза; у парагриппа два комплекса – гемагглютинин и нейраминидаза вместе и второй так называемый белок слияния; у вирусов иммунодефицита человека они представлены гликопротеидами. Большинство вирусов, патогенных для человека, являются сложно устроенными. Если у вируса отсутствует суперкапсид, то это просто устроенный вирус.
У большинства сложно устроенных вирусов суперкапсид – это модифицированная (путем встраивания белков вируса) цитоплазматическая мембрана клеток хозяина. Модификация идет путем встраивания шипиков вируса в участки цитоплазматической мембраны (ЦПМ). Исключение составляют поксвирусы, у которых суперкапсид вирусоспецифический, так как имеются собственные гены, ответственные за синтез суперкапсида. Если культивировать один и тот же вирус в разных клетках, получим разные по биохимическому составу суперкапсиды. Шипы выполняют роль прикрепительных белков на поверхности чувствительных клеток. Если их удалить жирорастворителем или детергентом, вирус полностью теряет инфекционную активность.
Биохимия вирусов также хорошо изучена. В состав вириона входят: белки – 70 – 80 %; нуклеиновые кислоты – 4 – 6 % (РНК), 20 – 30 % (ДНК-вирусы); липиды и углеводы в незначительных количествах.
Вирусные белки – полипептиды, которые состоят из обычных левовращающих аминокислот, отличающихся лишь последовательностью построения. Принцип субъединичности построения капсида – повторяющиеся полипептиды небольшой величины – позволяет экономить генетический материал. Если бы капсид был построен из разных белков, требовался бы огромный геном. Так, у вируса табачной мозаики масса капсида 37,2$106дальтон, а для кодирования этого капсида вирусом используется всего 600 нуклеотидов. Весь геном вируса составляет около 6000 нуклеотидов. Некоторые гены вирусов способны кодировать несколько белков со сдвигом рамки. Например, у вируса гриппа 8 генов, а кодируют они 10 вирусных белков.
Капсид за счет упорядоченности капсомеров по сравнению с простой пептидной цепью обладает меньшей свободной энергией. На уровне вирусов действует принцип саморегуляции – самосборки капсида. Принцип самосборки вирусных белков заключается в том, что при определенных условиях (рН, t°) наблюдается спонтанная сборка вирусных белков близких капсидов. При добавлении вирусных нуклеиновых кислот этот процесс упорядочивается.
В отличие от обычных у вирусных белков изменена чувствительность к протеазам. Белки вирусов выполняют защитную функцию, в том числе от нуклеаз, ультрафиолетового и ионизирующего излучений; обладают высокой, но не абсолютной устойчивостью, поскольку при репродукции необходимо «раздевание» вируса (освобождение генома). При этом изменяется чувствительность белков к протеазам. При проникновении в чувствительную клетку белки изменяются и легко гидролизуются протеазами. Вирусы проникают внутрь клетки за счет фагоцитоза вирусных частиц — виропексиса, либо слияния с клеточной мембраной.
Вирусные белки подразделяются на структурные и неструктурные. Структурные белки составляют суперкапсид, в составе сердцевины – геномные белки. Неструктурные белки не входят в состав вирусных частиц и обнаруживаются только в зараженной клетке в процессе репродукции. Это ферменты, осуществляющие функции регуляторов, и белки-регуляторы. Аминокислотная последовательность белков вирусов иная, чем у человека, поэтому их можно определять внутри клетки.
Синтез вирусных белков на рибосомах клеток идет по общим законам и регулируется информационной РНК (иРНК), которая образуется на матричных вирусных нуклеиновых кислотах. Белки вирусов выполняют защитную, адресную и регулирующие функции.
Защитная функция – это экранирование нуклеиновой кислоты вируса от химических факторов, нуклеаз и т. д., благодаря чему вирусы существуют тысячи лет.
Адресная функция состоит в проникновении только в нужную чувствительную клетку, а не в любую. Регулирующие функции выполняют внутриклеточные белки вирусов, ферменты, ферментные комплексы.
Вирусные нуклеиновые кислоты имеют существенные отличия от нуклеиновых кислот всех других существ. Обычно генетическая информация закодирована в двуспиральной ДНК и имеется однонитевая РНК (информационная, транспортная, рибосомальная). У вирусов в качестве геномной может быть как ДНК, так и РНК. У некоторых вирусов (РНК-геномных) вирионная РНК одновременно может выполнять роль информационной. Такие вирусы называют нитевыми. Если выделить в чистом виде такую РНК и поместить в клетку, то инфекция будет протекать так же, как если бы туда проник целый вирус. У других вирусов (нитевых) РНК не может выполнять функцию информационной.
Вирусы отличает многообразная структура нуклеиновых кислот. Их можно получить, разрушив вирус химическими (фенолом) или физическими (ультразвуком) факторами. Выделяют ДНК-содержащие вирусы, у которых она может присутствовать в виде: классической двунитевой (аденовирусы, герпесвирусы); двунитевой линейной с замкнутыми концами (оспа); двунитевой линейной с разрывами одной цепи (Т-фаги); с несколькими разрывами одной нити (каждый фрагмент – уникальный ген); двунитевой, замкнутой в кольцо со сверхвитками, (суперспирализация) или без них (тогавирусы); двунитевой, у которой внешняя нить замкнута в кольцо (L-нить), а у внутренней 1/3 отсутствует (S – нить, шорт) – гепаднавирусы; уникальной линейной однонитевой ДНК (парвовирусы); однонитевой замкнутой в кольцо (фаги).
РНК-содержащие вирусы также делятся на несколько типов: классический однонитевой линейный (пикорновирусы, тогавирусы, парамиксовирусы, рабдовирусы); линейный однонитевой фрагментированный (ортомиксовирусы); однонитевой фрагментированный, где каждый фрагмент замкнут в кольцо (буньявирусы); двунитевой с идентичными нитями (ретровирусы); двунитевой фрагментированный (реовирусы).
По химическому составу вирусные РНК и ДНК аналогичны клеточным, но в отличие от них содержат метилированный урацил.
Липиды имеют сложно устроенные вирусы, их наличие характерно для патогенных вирусов. Содержание липидов в вирусах различно: от 1,5 до 54 % (тогавирусы). Липидный состав вирусов непостоянен, у большинства это липиды клеточного происхождения. Липиды содержатся в суперкапсиде и зависят от клетки хозяина. Липидный состав различных чувствительных клеток при включении в них одного и того же вируса будет разным, тогда как одинаковые клетки при включении в них разных вирусов сохранят идентичность. Липиды выполняют важную защитную функцию, укрепляя белковый скелет суперкапсида. Они имеют вид липопротеидного или гликопротеидного комплекса. У поксвирусов синтезируются собственные липиды под контролем самого вируса, и поэтому состав липидов у них постоянен.
Углеводы входят в суперкапсид сложно устроенных вирусов преимущественно в составе различных шипов в виде моносахаридов, аминосахаридов (2 – 3 цепочки в комплексе с белковым или липидным компонентом – гликопротеидом, гликолипопротеидом). У вируса гриппа это гемагглютинин и нейраминидаза, у парагриппа – комбинированный шип гемагглютинина и нейраминидазы, у ВИЧ – поверхностные структуры gp 41- и gp 120-гликопротеиды, у вируса клещевого энцефалита – шипы гемагглютинина.
Углеводный компонент вируса определяется клеткой хозяина, укрепляет суперкапсидную структуру, придавая ей жесткость. Удаление гликопротеидных комплексов у сложно устроенных вирусов ведет к потере способности к адсорбции на чувствительных клетках. У просто устроенных вирусов углеводный компонент отсутствует.
В составе вирусов могут быть и другие компоненты. В состав полипептидов, например, часто включаются фосфаты (аденовирусы, ретровирусы, герпесвирусы, поксвирусы, ортомиксовирусы), их конкретная функция пока точно не установлена. Некоторые вирусы содержат микроэлементы: медь, молибден, а отдельные вирусы – целый набор ферментов: поксвирусы – 10, ВИЧ – 4, вирус гриппа – 3 фермента. Ферменты обеспечивают вирусную репродукцию: реакцию полимеризации (образования иРНК), репликацию (образование новых нитей нуклеиновых кислот) по принципу комплементарности. В ряде случаев ферменты синтезируются за счет генома вируса.
Вирусы также активно используют клеточные ферменты, например, у гриппа гемагглютинин находится в составе шипов в неактивном состоянии и для адсорбции на клеточном эпителии необходима протеолитическая активация гемагглютинина за счет ферментов клеточного секрета. Только после этого достигается соответствие прикрепительного белка структурам чувствительной клетки.
У ДНК-геномных вирусов ДНК-зависимая полимераза обеспечивает синтез иРНК. Благодаря ферментам происходит модификация синтезированной цепочки НК: удлинение цепи, укорочение, «подчищение» или процессинг нуклеиновых кислот – разрезание и удаление из определенных участков 1 – 2 нуклеотидов, а затем сшивание этого участка лигазой.
2.4. Бактериофаги
Бактериофаг – вирус бактерий, паразитирующий только на живой микробной клетке и являющийся важным генетическим фактором микроорганизмов. Открыт в 1917 г. французским ученым д’Эррелем. Название бактериофага происходит от греч. «фагос» – пожиратель. Бактериофаг имеет корпускулярное строение и представляет собой шаровидное тело (головку) с отростком. Вирус покрыт белковой оболочкой. В головке фага заключены ДНК или РНК. Размеры фага колеблются в пределах 45 – 100 нм (рис. 11).
По сравнению с вирусами фаги довольно устойчивы во внешней среде. Они хорошо переносят низкие температуры, но при +70 °C инактивируются. Формалин инактивирует фаги через несколько минут. Также губительно действуют на фаги ультрафиолетовое и ионизирующее излучения, однако в малых дозах они могут вызвать мутации.

Рис. 11. Начальные этапы взаимодействия фага с оболочкой бактерии (по: Воробьев А. А. и Кривошеин Ю. С., 2002)
Стадии взаимодействия бактериофага с бактериальной клеткой:
I фаза – адсорбция на клетке при соответствии фаговых рецепторов с рецепторами бактериальной клетки;
II фаза – внедрение фага в клетку, через канал фага в клетку попадает его нуклеиновая кислота; в отличие от вирусов капсидные белки головки и отростка остаются вне клетки;
III фаза – репликация фаговой РНК или ДНК, синтез фагоспецифических ферментов транскрипции и репликации;
IV фаза – сборка фаговых частиц, которая происходит гораздо быстрее, чем при репродукции других вирусов;
V фаза – выход фагов из клетки происходит по типу взрыва, во время которого зараженные бактерии лизируются.
Существуют вирулентные и умеренные фаги. Вирулентные фаги вызывают инфекцию, заканчивающуюся лизисом бактериальных клеток и синтезом новых фаговых частиц. Умеренные фаги не лизируют зараженные ими клетки. ДНК этих фагов включается в хромосому бактерий и передается при их делении неограниченному числу потомков. Такой тип взаимодействия фага с клеткой называется лизогенией, а бактерии, несущие в геноме фаговую ДНК (профаг), называются лизогенными. Они широко распространены в природе и обнаруживаются в воде, почве, сточных водах, испражнениях больных и других биосубстратах.
Репродукция вирулентного фага в клетках бульонной бактериальной культуры сопровождается их лизисом и просветлением среды. На газоне чувствительных бактерий, выращенных на агаровой среде в чашке Петри, фаги образуют зоны очагового или сплошного лизиса, что зависит от их концентрации. Зоны очагового лизиса получили название негативных колоний фага или стерильных пятен-бляшек. Они имеют морфологию, характерную для определенных фагов, и образуются из одной фаговой частицы при внедрении ее и последующей репродукции в клетках микроорганизмов.
Большинство фагов характеризуется видоспецифичностью в отношении бактерий. Однако существуют фаги, способные поражать только отдельные варианты одного и того же вида бактерий. Их используют для определения фаговаров (фаготипов) внутри данного вида.
В практической работе фаги применяют для:
– фаготипирования бактерий, что важно для маркировки исследуемых культур при эпидемиологическом анализе заболеваний;
– дифференцировки бактериальных культур с целью установления их видовой принадлежности;
– фагодиагностики, заключающейся в выделении фага из организма больного (например, из испражнений), что косвенно свидетельствует о наличии в материале соответствующих микроорганизмов.
Фаги, так как они обладают антигенными свойствами, используют также для иммунизации животных с целью получения диагностических антифаговых сывороток. Кроме того, в отдельных случаях их применяют для лечения инфекционных заболеваний (фаготерапии).
2.5. Прионы
В 1957 г. американский врач Д. К. Гайдушек при обследовании в Новой Гвинее больных куру – смертельным дегенеративным заболеванием мозга, связанным с ритуальным каннибализмом, обратил внимание на сходство этого заболевания с давно известным медленным вирусным заболеванием овец – скрепи. Позже было выявлено сходство в развитии и некоторых других заболеваний, например болезни Крейтцфельдта – Якоба (БКЯ). За исследования в этой области Д. К. Гайдушек в 1976 г. был удостоен Нобелевской премии.
Инфекционный агент этих заболеваний имел важные отличия от других возбудителей, в том числе вирусов (табл. 1): он не был виден в электронный микроскоп, не вызывал иммунных реакций, не инактивировался факторами, разрушающими нуклеиновые кислоты, имел крайне малые размеры (меньше 25 нм). Ранее было высказано предположение, что этот агент представляет собой принципиально новый тип возбудителя – инфекционный белок.
Таблица 1
Сравнительная характеристика вирусов и прионов

В 1982 г. американский ученый С. Прузинер, используя новые подходы к накоплению и очистке возбудителя, выделил соответствующую протеиновую фракцию. Он доказал, что этот белок способен вызывать спонгиформную энцефалопатию и назвал его прионом (сокращение от протеиновые инфекционные нуклеолы). В 1984 г. С. Прузинер установил, что прионы лежат в основе как наследственных, так и инфекционных болезней, что вызвало полное недоумение многих специалистов. Значительно позже, в 1997 г., этому ученому была присуждена Нобелевская премия в области физиологии и медицины за серию научных работ о прионах.
Существуют так называемые «конформационные» болезни, которые характеризуются пространственным изменением третичной структуры внутриклеточных белков с образованием жесткой бетаструктуры вместо нормальной альфа-спиральной. Бета-структуры, в отличие от альфа-структур, становятся устойчивыми к расщепляющим их ферментам, вследствие чего накапливаются, агрегируются и полимеризуются, формируя различные специфические и неспецифические внутриклеточные включения (фибриллы, агрегаты и амилоид). Некоторые из них приобретают новые, в частности нейротоксичные, свойства, становясь причиной развития целого ряда нейродегенеративных заболеваний (болезни Альцгеймера, бокового амиотрофического склероза и др. ).
Конформационные изменения белков в организме в определенных условиях происходят и в норме, однако в условиях патологии процесс изменения структуры белка резко ускоряется, что может быть обусловлено как эндогенными (мутации, ошибки транскрипции и трансляции), так и экзогенными факторами (окислительный процесс, вирусы и их генные продукты). Таким образом, среди конформационных болезней можно выделить инфекционные, наследственные и спорадические формы. Некоторые конформационные болезни могут проявляться во всех трех формах. К числу последних относятся крайне актуальные в настоящее время прионные инфекции. Прионы представляют собой сиалогликопротеид (PrP) с молекулярной массой 33 – 35 кД, состоящий из 254 аминокислот (включая 22-членный N-терминальный сигнальный пептид), к боковым цепям которых присоединены остатки сахаров. Прионный белок очень устойчив к различным физическим факторам и химическим веществам. Инактивации его можно добиться только обработкой 90 % фенолом и автоклавированием при самом жестком режиме (табл. 2).
Таблица 2
Устойчивость прионов к различным воздействиям (по: Шлопов В. Г., 1998)

Сиалогликопротеид PrP входит в состав наружных клеточных мембран и является компонентом многих клеток организма, хотя максимальная его концентрация выявляется в нейронах. Делеция гена PRNP не приводит к немедленной смерти животных, однако через 70 недель у мышей развиваются прогрессирующие симптомы атаксии и нарушается моторная координация.
Прион PrP существует в двух изоформах: нормальной, неинфекционной (PrPC), и патологической, инфекционной (PrPSc). Молекулярная масса их одинакова и кодируется одним геном, расположенным на коротком плече 20-й хромосомы. Этот ген найден у многих млекопитающих и птиц.
Прион PrPSc значительно более устойчив к действию клеточных протеаз по сравнению с PrPC и может денатурироваться и ренатурироваться без потери инвазивной способности. При анализе первичной структуры PrPC выявлена его 80 %-ная гомология у разных видов животных. При этом около 42 % нормальной изоформы PrPC составляют альфа-спирали при почти полном отсутствии бетаскладчатых структур (тяжей), в то время как для патологического PrPSc характерны бета-тяжи (43 %) при уменьшении количества альфа-спиралей (30 %). При обработке реагентами, уменьшающими образование бета-тяжей, снижается инфекционность прионов и их устойчивость к действию протеазы К. Таким образом, в основе прионных заболеваний лежит посттрансляционное изменение конформации нормального клеточного белка с разрушением альфа-спиралей и образованием бета-структур.
В настоящее время различают не менее четырех типов прионных белков. Доказано, что с первым и вторым типами PrPSc связаны фамильные, спорадические и ятрогенные формы болезни Крейтцфельдта – Якоба. Четвертый тип, возможно, является возбудителем новой атипичной формы этой болезни и больных животных («бешенство» коров).
Возможна как наследственная передача по аутосомно-доминантному типу наследования, так и заражение алиментарным или парентеральным (ятрогенным) путем, причем при повторном инфицировании существует риск кумулятивного эффекта. Ятрогенный путь заражения может быть связан с использованием инфицированных электродов, хирургических, стоматологических и других инструментов, а также ряда лекарственных препаратов. При этом остается неясным вопрос безопасности использования препаратов, изготовленных из мозга и лимфоидной ткани крупного рогатого скота, – миелопептидов, стимуляторов, церебролизина, холестерина и т. д.
Алиментарный путь заражения связан с употреблением продуктов, инфицированных прионами. Этому способствует устойчивость прионов к протеазам пищеварительных соков. Широко известная эпидемия бешенства коров, затронувшая половину коровьих стад в Великобритании, была вызвана костной мукой, добавлявшейся в корм животным. Костная мука изготовлялась из мяса и костей погибших овец, большинство из которых страдали болезнью скрепи. После изменения технологии обработки костной муки (прекращения экстрагирования жиров и снижения температуры ее стерилизации) в начале 1980-х годов было зарегистрировано два случая «бешенства» коров. Далее эпизоотия развивалась крайне интенсивно, достигнув пика к 1992 г. В 1990 г. описан первый случай губчатой энцефалопатии у кошки в Великобритании, вскоре поступили сообщения о подобных заболеваниях у пумы, гепарда, тигра и других представителей семейства кошачьих, а также у диких экзотических копытных в лондонском зоопарке. Временно́е и географическое распространение губчатой энцефалопатии кошек дало основание полагать, что ее источником является корм, полученный из мяса крупного рогатого скота, а заражение копытных обусловлено использованием костной муки. В 1996 г. представлены доказательства – идентичность штаммов инфекционного прионного белка – в пользу связи потребления мяса зараженных животных и так называемого «нового варианта» болезни Крейтцфельдта – Якоба (БКЯ), отличающегося более коротким инкубационным периодом (2 – 5 лет), молодым возрастом заболевших (до 40 лет) и клиническими проявлениями, аналогичными таковым при болезни куру.
Таблица 3
Инфекционность тканей, биологических жидкостей и экскретов больных (по данным ВОЗ)

Остается проблемой также использование субпродуктов в пищевой, фармацевтической и косметической промышленности, например желатина, который изготавливается из кожи и костей, но может содержать небольшое количество костного мозга, инфицированного прионами, а также кремов и других косметических и фармацевтических препаратов, содержащих коллаген, полученный из тканей коров и т. д. (табл. 3). Необходимо отметить, что ткани остаются заразными даже после их фиксации формалином. Существует видовой барьер к прионным инфекциям у различных видов животных, что может быть связано с различными структурами генов, кодирующих PrP. В большинстве случаев эти барьеры не абсолютны, они не препятствуют, а только затрудняют передачу инфекции от особей одного вида особям другого вида. На межвидовой перенос влияют два фактора: во-первых, эффект вида донора, связанный с различиями в последовательностях гена PrP у двух видов донор – реципиент, и, во-вторых, штаммовые особенности приона, определяющие степень сложности преодоления межвидового барьера.
Первоначально после заражения прионы появляются в лимфоидной ткани – лимфатических узлах, селезенке, тимусе, особенно в В-клеточных зонах. О важной роли В-лимфоцитов в патогенезе прионных инфекций говорит устойчивость мышей к скрепи с дефицитом этих клеток. В лимфоидной ткани происходит частичная репликация прионов, затем они по нервам достигают ближайших аксонов. После размножения в аксонах прионы продвигаются к спинному, затем к головному мозгу со скоростью около 1 мм в день, где их репликация может происходить как в нейронах, так и в глиальных клетках. Внутриклеточное накопление PrPSc в головном мозге проявляется вакуолизацией и дегенерацией нейронов, их гибелью и реактивным астроцитозом. Внеклеточные скопления PrPSc выявляются как амилоидные бляшки. Максимум инфекционности достигается задолго до клинических проявлений заболевания, с чем связаны трудности ранней диагностики и опасность передачи инфекции с продуктами питания.
Заболевания, вызываемые прионами, характеризуются длительным инкубационным периодом (до 40 лет), отсутствием воспалительных изменений, прогрессированием симптомов без ремиссий и выздоровления, отсутствием продукции интерферона и чувствительности к нему, интактностью Т- и В-клеток, устойчивостью к иммуноподавляющему или иммуностимулирующему действию гормонов и других препаратов.
Все прионные инфекции характеризуются прогрессирующей дегенерацией ЦНС с преимущественным поражением серого вещества, выявляется также вторичная потеря миелина и поражение белого вещества. Макроскопически выявляется снижение объема мозга и уменьшение толщины его коры, гистологически – вакуолизация нейронов и предельное уменьшение их количества, что сопровождается пролиферацией и гипертрофией астроцитов. Для прионных инфекций характерны также спонгиоформные изменения с образованием вакуолей от 5 до 100 мкм в диаметре между телами нервных клеток. В мозговой ткани накапливается патологический белок с массой 27 – 30 кД, состоящий из 55 аминокислот, который является дериватом большого белка-предшественника PrPSс после его расщепления протеазой К.
Таблица 4
Прионные заболевания человека и животных

Прионные заболевания всегда смертельны, гибель наступает от истощения или от пневмонии. Их типичными клиническими проявлениями являются:
– расстройства чувствительной сферы – амнезия различной степени, потеря и извращение чувствительности, выпадение функций органов чувств;
– нарушения двигательной сферы – атаксия, обездвиживание, атрофия мышц, в том числе дыхательных, параличи;
– нарушения психики – утрата профессиональных навыков, депрессия, сонливость, агрессивность, снижение интеллекта до полной деменции.
К прионным болезням человека в настоящее время относят пять заболеваний (табл. 4), которые обусловлены различными мутациями одного PRNP гена человека: болезнь Крейтцфельдта – Якоба (БКЯ); синдром Герстмана – Штраусслера – Шейнкера (СГШШ); синдром фатальной бессонницы; болезнь куру; хроническая прогрессирующая энцефалопатия детского возраста (синдром Альперса).
В настоящее время не существует эффективной этиотропной и патогенетической терапии прионных болезней. На ранних стадиях используется симптоматическая терапия для коррекции расстройств сна, поведенческих нарушений, миоклонии; на поздних – поддерживающая терапия.
Перспективным направлением в лечении прионных заболеваний можно считать создание препаратов, направленных на стабилизацию альфа-структур PrP, снижение их количества и предотвращение конформационных изменений. В эксперименте амфотерицин, некоторые ингибиторы синтеза вирусного гликопротеида и кортикостероиды увеличивают инкубационный период, а некоторые антибиотики несколько удлиняют продолжительность жизни животных, зараженных скрепи. Брефелдин А разрушает аппарат Гольджи и препятствует синтезу PrPSс в инфицированной культуре клеток.
Профилактика прионных заболеваний включает:
• использование генно-инженерных гормональных препаратов;
• ограничение трансплантации тканей;
•соблюдение при работе с биологическими жидкостями и тканями правил, предусмотренных для работы с больными СПИДом;
• уничтожение хирургических инструментов, используемых у больных БКЯ либо обработка их гипохлоритом с последующей очисткой и автоклавированием при температуре 134 °C в течение 1 часа;
• запрет на использование пищи, подозрительной на содержание инфекционного прионного белка;
• разведение пород домашних животных, резистентных к прионам;
• выявление носителей патогенных мутаций и т. п.
Прижизненная диагностика прионных заболеваний затруднена. Для установления точного диагноза прионного заболевания человека требуется, чтобы был выявлен один из четырех дополнительных критериев:
• наличие PrP амилоидных бляшек;
• способность ткани к заражению спонгиоформной энцефалопатией животных;
• наличие изоформ прион-протеина PrPSc;
• наличие патогенного мутированного гена PRNP.
На ранних этапах заболевания большое значение в диагностике прионных болезней имеет электроэнцефалографическое исследование, при котором можно выявить замедление биоэлектрической активности. Комьютерная томография позволяет определить прогрессирующую атрофию головного мозга.
Для выявления прионного белка PrPSc в биоптате мозговой ткани и глоточной миндалины используются методы иммуноцитохимического анализа, гисто- и иммуноблоттинга.
Для определения инфекционности тканей проводится внутримозговое заражение лабораторных животных. Исследование может проводиться только в специализированных лабораториях и зависит от ряда факторов, например от видового барьера. В. А. Зуевым предложено использование перевиваемых культур клеток невриномы узла тройничного нерва крыс для культивирования прионов и прижизненной диагностики прионных заболеваний, а также выявления антител к нейрофиламентам.
Глава 3 ФИЗИОЛОГИЯ И БИОХИМИЯ МИКРООРГАНИЗМОВ
3.1. Метаболизм
Метаболизм представляет собой совокупность двух противоположных, но взаимосвязанных процессов: энергетического метаболизма (катаболизма) и пластического (конструктивного) метаболизма (анаболизма).
Прокариоты, как и эукариоты, в процессе ферментативных катаболических реакций выделяют энергию, которая аккумулируется в молекулах АТФ. В процессе ферментативных анаболических реакций эта энергия расходуется на синтез многочисленных макромолекул органических соединений, из которых в конечном итоге строятся биополимеры – составные части микробной клетки. Взаимосвязь анаболизма и катаболизма выражается также в том, что на определенных этапах метаболизма образуются одинаковые промежуточные продукты (амфиболиты), которые используются в обоих процессах.
Метаболизм микроорганизмов характеризуется ярко выраженным разнообразием. В качестве питательных веществ микробные клетки используют различные органические и минеральные соединения.
3.2. Источники углерода и типы биологического окисления
В соответствии с законом сохранения энергии все функции живого организма, требующие затраты энергии, должны осуществляться за счет внешних источников энергии, которые бывают двоякого рода.
Автотрофные организмы могут синтезировать органические соединения из неорганических веществ (прежде всего из СО2 иН2О), используя дополнительные источники энергии. Гетеротрофные организмы используют в качестве источника энергии готовые органические «питательные вещества» и живут за счет автотрофных организмов и их биосинтетических процессов.
При распаде органических веществ химически связанная энергия освобождается (катаболизм, диссимиляция). Этот распад без участия кислорода (анаэробные условия) приводит к образованию органических продуктов, богатых энергией, таких, как органические кислоты или этанол (брожение), а при использовании кислорода (аэробные условия) – конечных продуктов: углекислого газа и воды (дыхание), бедных энергией.
Суммарные уравнения дыхания складываются из двух процессов:
1) постепенного расщепления субстрата с отнятием водорода, который связывается с коферментами;
2) постепенного окисления водорода в результате переноса его на кислород.
Расщепление углеводов происходит в результате последовательного воздействия на субстрат различных ферментов. Этот процесс начинается с гликолиза. При подготовке к расщеплению различные углеводы превращаются в фруктозо-1,6-фосфат. Гликолиз – это процесс окислительного расщепления, происходящий в цитоплазме бактерий и ведущий от фруктозо-1,6-фосфата к промежуточному продукту – пировиноградной кислоте.
При разных видах брожения дальнейшая судьба продуктов гликолиза – пировиноградной кислоты и NAD ⋅ Н – различна.
При молочнокислом брожении (стрептококки, лактобациллы) водород переносится на пировиноградную кислоту и образуется молочная кислота:

При спиртовом брожении (сахаромицеты) пировиноградная кислота сначала декарбоксилируется, т. е. от нее отщепляется СО2,азатем промежуточный продукт (ацетальдегид) восстанавливается в этиловый спирт (этанол) в результате переноса водорода:

При маслянокислом брожении (клостридии) пировиноградная кислота превращается в ацетат [C H 3 −C=0], связанный с коферментом (ацетил-СоА). Два таких остатка соединяются в ацетоацетат, который восстанавливается до н-масляной кислоты (СН3СН2СН2СООН).
В 30-е годы XX века В. А. Энгельгардом, О. Варбургом, Ф. Лимпаном и Д. Диккенсаном было доказано, что кроме гликолиза в бактериальных клетках существует еще один путь расщепления углеводов – ступенчатый окислительный распад гексоз до пентоз и других сахаров с более короткой цепью. Ключевую роль в таких реакциях играют пентозофосфаты, в связи с чем этот цикл называется пентозофосфатным.
Суммарное уравнение этого цикла имеет вид:
Небольшое число микроорганизмов, к которым относятся главным образом бактерии из рода Pseudomonas, получают энергию с помощью специфического метаболического пути – Энтнера – Дудорова. Существует предположение, что он появился в связи с высокой потребностью прокариот в пировиноградной кислоте как кратчайшему пути ее образования (всего 4 реакции, тогда как при гликолизе она образуется после 9 реакций).
В аэробных условиях пировиноградная кислота (ПВК) подвергается окислительному декарбоксилированию в цикле трикарбоновых кислот до конечных продуктов: СО2 иН2О. Непосредственным реакциям цикла предшествует подготовительная фаза – окисление пировиноградной кислоты до ацетилкоэнзима А (ацетил = СоА):

Окислительное декарбоксилирование ПВК катализируется пируватдегидрогеназной системой. Она состоит не менее чем из трех ферментов, которые используют пять коферментов: тиамидинфосфат, амид липоевой кислоты, коэнзим А, FAD, NAD.
При аэробном окислении 1 моля глюкозы клетка получает 38 молей АТФ, тогда как при гликолизе только два.
В цикле трикарбоновых кислот от субстратов отделяются протоны и электроны. Они поступают на коферменты NAD+ и FAD+, которые передают их в дыхательную цепь, образованную окислительно-восстановительными ферментами, находящимися на плазматической мембране у прокариот и на внутренней мембране митохондрий у эукариот. Передвигаясь от одного переносчика электронов к другому, электроны опускаются на все более низкие энергетические уровни, отдавая порциями свою энергию. В последнем звене цепи они восстанавливают молекулярный кислород. Освобожденная при переносе электронов по дыхательной цепи энергия запасается в фосфатных связях АТФ. Окислительно-восстановительные ферменты представлены дегидрогеназами, флавопротеидами, цитохромами, а также убихиноном и белками, содержащими железо и серу.
Автотрофный метаболизм осуществляется бактериями путем фотосинтеза и хемосинтеза. Для облигатных автотрофов фотосинтез – единственный источник энергии: у них нет процессов диссимиляции, поставляющих АТФ. Фотосинтез состоит из двух фаз: световой и темновой. Световой процесс можно представить так:

Во время темновой фазы атомы водорода, поставляемые световыми реакциями, используются для восстановления СО2 до углеводов согласно общему уравнению фотосинтеза:

При этом на каждый моль синтезированного углевода запасается около 160 кДж энергии.
Русским микробиологом С. Н. Виноградским было показано, что хемосинтезирующие бактерии получают энергию при окислении неорганических соединений:

Хемосинтез (в отличие от фотосинтеза) – облигатно аэробный процесс.
При аэробном (кислородном) дыхании конечным акцептором электронов служит кислород, а при анаэробном (бескислородном) – неорганические соединения. Исходя из этого, по типу дыхания выделяют следующие группы бактерий:
– строгие (облигатные) аэробы, которые размножаются только в присутствии кислорода, например псевдомонады;
– микроаэрофилы, которым требуется меньшее количество кислорода, например кампилобактеры;
– факультативные анаэробы, которые могут размножаться как в аэробных, так и в анаэробных условиях, например энтеробактерии;
– строгие (облигатные) анаэробы, которые размножаются только в бескислородных условиях, например бактероиды.
Отдельно следует выделить аэротолерантные бактерии, которые способны расти в присутствии кислорода, но они не используют этот кислород в качестве источника энергии, а получают энергию при брожении, например молочнокислые бактерии.
Токсическое действие кислорода на бактерии объясняется отсутствием у них ферментов каталаз и системы регуляции окислительно-восстановительного потенциала.
3.3. Источники азота
Для синтеза азотсодержащих соединений (аминокислот, пуринов, пиримидинов, некоторых витаминов) микроорганизмы нуждаются в доступном источнике азота. Одни из них способны усваивать молекулярный азот из атмосферы (азотфиксирующие бактерии), другие ассимилируют только азотсодержащие органические соединения.
Микроорганизмы, способные синтезировать все необходимые им органические соединения из глюкозы и солей аммония, называют прототрофами. В отличие от них микроорганизмы, не способные синтезировать какое-либо из жизненно необходимых соединений, называют ауксотрофами. Они ассимилируют эти и другие соединения в готовом виде из окружающей среды или организма хозяина. Ауксотрофами чаще всего являются патогенные или условно-патогенные для человека микроорганизмы.
Кроме азота и углерода всем микроорганизмам для биосинтетических реакций необходимы соединения, содержащие фосфор, серу, а также ионы магния, калия, кальция, железа и другие микроэлементы.
Потребность того или иного микроорганизма в определенных факторах роста является стабильным признаком, который используется для дифференциации и идентификации бактерий, а также при изготовлении питательных сред для лабораторных и биотехнологических целей.
Многие микроорганизмы, особенно бактерии, нуждаются в тех или иных аминокислотах (одной или нескольких), поскольку не могут их самостоятельно синтезировать: клостридии нуждаются в лейцине, тирозине; стрептококки – в лейцине, аргинине и др. Такого рода микроорганизмы называются ауксотрофными по тем или иным аминокислотам, которые они не способны синтезировать.
Пуриновые и пиримидиновые основания и их производные (аденин, гуанин, цитозин, урацил, тимин и др.) являются факторами роста для разных видов стрептококков, некоторые азотистые основания нужны для роста стафилококков и других бактерий. В нуклеотидах нуждаются некоторые виды микоплазм.
Липиды, в частности компоненты фосфолипидов – жирные кислоты, необходимы для роста некоторых стрептококков и микоплазм. Все виды микоплазм ауксотрофны по холестерину и другим стеринам, что отличает их от других прокариот. Эти соединения входят в состав их цитоплазматической мембраны.
Витамины, главным образом группы B, входят в состав коферментов и или их простетических групп. Многие бактерии ауксотрофны по определенным витаминам. Например, шигеллы нуждаются в никотиновой кислоте или ее амиде, который входит в состав NAD и NADF, стафилококки и бруцеллы – в тиамине (B1), входящем в состав пирофосфата. Кроме того, факторами роста для многих бактерий являются фолиевая кислота, биотин, а также гемы – компоненты цитохромов. Последние необходимы гемофильным бактериям, микобактериям туберкулеза и др.
Метаболиты и различные ионы проникают в микробную клетку путем пассивной диффузии, облегченной диффузии, активного транспорта и при участии фосфотрансферазной системы (рис. 12). Два первых пути не требуют энергетических затрат. Облегченная диффузия протекает при участии ферментоподобных белков — пермеаз. Этими путями в клетку переносится ограниченное количество соединений. Большинство метаболитов, ионов и других веществ транспортируется в клетку активным путем с помощью специфических пермеаз, локализованных в цитоплазматической мембране. Данный процесс требует энергетических затрат и происходит даже в тех случаях, когда концентрация упомянутых соединений в среде ниже, чем в микробной клетке. При этом каждая пермеаза переносит в клетку только определенную аминокислоту или другое соединение. Фосфотрансферазная система состоит из ферментов I и Hpr, а также набора субстратов, осуществляющих фосфорилирование.

Рис. 12. Проникновение питательных веществ в бактериальную клетку:
Различная длина стрелок указывает на сдвиг равновесия. S – высокая, а s – низкая концентрация растворенных веществ; С – пермеазы; R – белок Hpr; R-ф – фосфо-Hpr; S-ф – фосфатная группа (по: Стейнер Р., 1979)
В процессе переноса может произойти химическая модификация вещества, например фосфорилирование углеводов при участии соответствующих ферментов.
Микроорганизмы синтезируют самые разнообразные ферменты (энзимы). Ферментный состав любого микроорганизма определяется его геномом и является достаточно стабильным признаком. Поэтому определение сахаролитических, протеолитических и других ферментов, образуемых определенными видами бактерий, широко применяется для их идентификации. Вместе с тем многие ферменты (нейраминидаза, гиалуронидаза, коагулаза и др.) способствуют проявлению патогенных свойств у возбудителей некоторых инфекционных заболеваний, поскольку субстратом их действия являются вещества, входящие в состав клеток и тканей организма человека.
Одни ферменты микроорганизмов локализуются в их цитоплазме, цитоплазматической мембране и периплазматическом пространстве, другие выделяются в окружающую среду. На этом основано деление ферментов на экзо- и эндоферменты. Экзоферменты расщепляют макромолекулы в окружающей среде до более простых соединений, которые затем транспортируются в микробную клетку. Некоторые ферменты, локализованные в цитоплазме, функционируют независимо друг от друга, другие тесно связаны между собой, обеспечивая протекание метаболических реакций в определенной последовательности. Внутриклеточные ферменты, объединенные структурно и функционально, например ферменты дыхательной цепи, локализованные на цитоплазматической мембране, составляют мультиферментные комплексы.
Ферменты, которые постоянно синтезируются в микробных клетках в определенных концентрациях, называют конститутивными. К ним относятся ферменты гликолиза. Ферменты, концентрация которых резко возрастает при наличии соответствующего субстрата, называют индуцибельными (индукция субстратом). К ним относятся ферменты транспорта и катаболизма лактозы – галактозидпермеаза; β-галактозидаза и галактозидацетилтрансфераза; фермент, разрушающий пенициллин, – β-лактамаза. В отсутствие субстрата они находятся в бактериальной клетке в следовых концентрациях, а при наличии соответствующего индуктора их количество резко возрастает.
Функциональная активность ферментов и скорость ферментативных реакций зависят от условий, в которых находится данный микроорганизм, и прежде всего от температуры и pH среды. Для многих патогенных микроорганизмов оптимальными являются температура 37 °C и pH 7,2 – 7,4.
3.4. Биосинтез углеводов, аминокислот и липидов
Микроорганизмы синтезируют моно-, олиго-, полисахариды и другие соединения, в состав которых входят углеводы. Автотрофы синтезируют глюкозу из углекислого газа (CO2) атмосферного воздуха. Гетеротрофы синтезируют глюкозу из углеродсодержащих соединений с длиной цепи C2– C3. В обоих случаях используются в основном реакции гликолиза, идущие в обратном направлении.
Большинство прокариот способны синтезировать все аминокислоты из пирувата. Источниками энергии являются молекулы АТФ. При образовании аминокислот азот вводится в молекулу предшественника на последних этапах биосинтеза при помощи реакций аминирования и переаминирования. Переход неорганического азота в органический происходит через ионы аммония, которые включаются в состав органических соединений. Только несколько аминокислот (L-аланин, аспартат и L-глутамат) образуются путем прямого аминирования, остальные – путем переаминирования.
Вместе с тем многие микроорганизмы могут получать аминокислоты из молекул белка, которые предварительно расщепляются ими с помощью протеаз и пептидаз. Образовавшиеся олигопептиды и аминокислоты переносятся в микробные клетки, где включаются в метаболические пути биосинтеза или подвергаются дальнейшему расщеплению. Ауксотрофные по некоторым аминокислотам прокариоты (ряд патогенных бактерий, микоплазмы, спирохеты) потребляют их в готовом виде в организме хозяина.
Липиды микроорганизмов представлены жирными кислотами, фосфолипидами, воском, терпенами, каротиноидами, которые содержат длинноцепочечные насыщенные и ненасыщенные жирные кислоты.
Важную роль в биосинтезе жирных кислот у микроорганизмов играют так называемые ацилпереносящие белки. В ходе биосинтеза к ним присоединяются ацильные фрагменты с образованием тиоэфиров. Последовательное удлинение этих фрагментов приводит в конечном итоге к образованию высших жирных кислот, содержащих обычно 16 – 18 углеродных атомов.
Многие микроорганизмы синтезируют ненасыщенные жирные кислоты с двойными связями, которые формируются из соответствующих насыщенных кислот. У аэробов этот процесс требует присутствия кислорода. Микоплазмы получают жирные кислоты в готовом виде из клеток хозяина или из питательной среды.
Центральную роль в биосинтезе фосфолипидов играет цитидинфосфатглицерид, являющийся непосредственным предшественником фосфатидилглицерина, фосфатидилинозита и фосфатидилглицерофосфата. Остальные фосфолипиды образуются путем ферментативных превращений этих соединений.
3.5. Рост и размножение микроорганизмов
Для роста и размножения микроорганизмов необходимы минеральные соединения, содержащие катионыNH+4,K+,Mg2+ и др. Ионы аммония используются некоторыми бактериями для синтеза аминокислот, ионы калия – для связывания тРНК с рибосомами. Благодаря значительной внутриклеточной концентрации ионов калия в бактериальных клетках поддерживается высокое осмотическое давление. Ионы магния выполняют роль кофактора в ряде ферментативных процессов. Ионы трехвалентного железа входят в состав цитохромов и других гемопротеидов. Для ряда патогенных и условно-патогенных бактерий (эшерихии, шигеллы и др.) потребление трехвалентного железа в организме хозяина затруднено из-за нерастворимости его соединений при нейтральных и слабощелочных значениях pH. Некоторые микроорганизмы вырабатывают особые вещества — сидерофоры, которые связывают трехвалентное железо и делают его соединения растворимыми и транспортабельными. Бактерии активно ассимилируют анионы SO 42– иPO 43– для синтеза соединений, содержащих эти элементы (серосодержащие аминокислоты, фосфолипиды и др.).
Под термином рост следует понимать необратимое увеличение массы и размеров тела живых существ, для бактерий – увеличение количества клеток и клеточной массы.
Бактерии обычно размножаются бесполым путем – делением. Из одной клетки образуются две, каждая из которых делится в свою очередь. Такое деление при благоприятных условиях может продолжаться бесконечно долго. Вначале делится нуклеоид, затем между двумя будущими клетками образуется перегородка, состоящая из двух слоев цитоплазматической мембраны. Затем между этими двумя слоями появляется материал, из которого образуются два слоя клеточной оболочки. После расслоения клеточных оболочек клетки расходятся.
Грамположительные бактерии делятся посредством образования перегородки, вырастающей от клеточной стенки к центру. У микобактерий перегородка образуется внутри клетки, затем расщепляется на два слоя и разделяет клетку на две. Грамотрицательные бактерии, как правило, истончаются в центре и разделяются перегородкой на две клетки.
Скорость размножения микроорганизмов зависит от состава среды, температуры, условий питания, влажности и ряда других факторов. При благоприятных условиях многие бактерии делятся через 20 – 30 мин.
Недостаток пищи и накопление продуктов распада ограничивают скорость размножения. В проточной среде с непрерывно обновляющимся составом бактерии могут делиться каждые 15 мин. Скорость размножения различных видов бактерий неодинакова даже при наличии тождественных условий. Процесс размножения бактерий в свежей питательной среде включает в себя несколько этапов. Стационарная фаза – период задержки размножения. В этот период, который длится 1 – 2 ч, бактерии, внесенные в свежую питательную среду, не размножаются. Лаг-фаза – приспособление бактерий к новой среде и к последующему размножению в ней. К концу лаг-фазы объем клеток увеличивается. Длительность лаг-фазы зависит как от внешних условий, так и от возраста бактерий и их видовой специфичности. Лаг-фаза развития – время интенсивного логарифмического или экспоненциального размножения. В данный период размножение бактерий идет с максимальной скоростью, а число клеток увеличивается в геометрической прогрессии.
За этими фазами наступает стадия, характеризующаяся постепенным уменьшением количества жизнеспособных бактерий вследствие истощения источников энергии, накопления продуктов метаболизма и других факторов.
Культура бактерий в ограниченном объеме питательной среды называется периодической, и описанные фазы роста характерны именно для таких культур. Если благоприятные для роста бактерий условия поддерживать путем подачи свежей питательной среды и оттока продуктов распада, то их культивирование станет непрерывным. Это происходит при различных биотехнологических процессах.
По типу дыхания риккетсии являются аэробами. Их характерными метаболическими признаками являются: полное окисление глутаминовой кислоты и отсутствие утилизации глюкозы. Риккетсии имеют белковые эндотоксины, чувствительные к формалину.

Рис. 13. Колонии микоплазм
Риккетсии размножаются путем обычного деления кокковидных и палочковидных форм с последующей фазой гомогенных популяций. Другой формой размножения является мицеллярное (как у грибов) дробление нитевидных форм. Нитевидные формы соответствуют наиболее ранней фазе развития риккетсий, а кокковидные и короткие палочковидные формы представляют конечную стадию их деления. Риккетсии размножаются гораздо медленнее, чем бактерии.
Размножение микоплазм не может происходить без участия стерола. Хотя микоплазмы и могут расти на искусственных питательных средах, для своего роста они нуждаются также в холестерине, жирных кислотах и нативном белке. Микоплазмы проникают через водную пленку и адсорбируются агаром. Через 18 ч внутри агара формируются маленькие сферические колонии, через 48 ч эта колония достигает поверхности водной пленки агара. Внешние колонии микоплазм имеют вид яичницы-глазуньи (рис. 13).
Хламидии существуют в двух формах, различающихся по морфологическим и биологическим свойствам. Инфекционной внеклеточной формой является элементарное тельце (ЭТ), а вегетативной, репродуцирующейся, внутриклеточной – ретикулярное тельце (РТ). Элементарное тельце имеет вид сферы диаметром 0,15 – 0,2 мкм, ретикулярное – имеет структуру типичных грамотрицательных бактерий размером около 1 мкм (рис. 14). В ЭТ содержится больше дисульфидных связей, что позволяет им противостоять осмотическому давлению.
Первый этап инфекционного процесса – адсорбция ЭТ на плазмалемме клетки-хозяина. Важную роль здесь играют электростатические силы. Внедрение хламидий происходит путем эндоцитоза. Инвагинация участка плазмалеммы с адсорбированным ЭТ происходит в цитоплазму с образованием фагоцитарной вакуоли. Эта фаза занимает 7 – 10 ч, затем в течение 6 – 8 ч происходит реорганизация ЭТ в вегетативную форму – ретикулярное тельце, способное к росту и делению. Именно в этой фазе эффективно применение антибактериальных препаратов, поскольку ЭТ к ним не чувствительно.

Рис. 14. Цикл размножения хламидий (стадии развития от попадания ЭТ в клетку до выхода ЭТ следующего поколения):
1 – адсорбция элементарного тельца; 2 – проникновение элементарного тельца в клетку; 3 – реорганизация элементарного тельца в ретикулярное тельце; 4 – деление ретикулярного тельца; 5 – созревание ретикулярных телец в элементарные; 6 – накопление ретикулярных телец в эндосоме; 7 – выход хламидий из клетки
Размножение хламидий приводит к формированию включений, известных под названием телец Провачека. В течение 18 – 24 ч развития они локализованы в цитоплазматическом пузырьке, образованном из мембраны клетки-хозяина. Во включении может содержаться от 100 до 500 хламидий. Остановка процесса на этой стадии ведет к персистенции хламидийной инфекции. Далее начинается процесс созревания ретикулярных телец через переходные (промежуточные) тельца в течение 36 – 42 ч развития в ЭТ следующего поколения. Полный цикл репродукции хламидий равен 48 – 72 ч и завершается разрушением пораженной клетки. В случае возникновения для хламидий неблагоприятных метаболических условий этот процесс может затягиваться на более длительный период.
Хламидии могут высвобождаться из инфицированной клетки через узкий ободок цитоплазмы. При этом клетка может сохранять жизнеспособность, этим можно объяснить бессимптомность течения хламидийной инфекции.

Рис. 15. Артроспоры культуры гриба Trichosporon beigelii
Грибы размножаются как половым, так и бесполым (вегетативным) способом. Последний осуществляется с помощью простого митоза. Основные способы размножения:
1) фрагментация гифов мицелия грибов, в результате чего образуются артроспоры (рис. 15); если они образуют толстостенную оболочку, то называются хламидоспорами, высокоустойчивы к действию неблагоприятных факторов внешней среды;
2) почкование, в результате которого образуются бластоспоры;
3) образование бесполых спор, которое у одних грибов происходит в специальных вместилищах (спорангиях) — спорангиоспоры (эндоспоры); у других – на специализированных гифах-конидиеносцах — экзоспоры, или конидии (рис. 16).
Число, форма и размер конидий имеют особую организацию. Некоторые виды способны образовывать различные типы конидий – одноклеточные (микроконидии) либо многоклеточные (макроконидии). Бесполые структуры грибов называются анаморфами, а половые — телеоморфами. Последние наиболее значимы для систематики грибов. Половые стадии обнаружены у совершенных грибов, принадлежащих к классам Ascomycetes и Basidiomycetes, а также у немногочисленных представителей класса Zygomycetes. Процесс созревания половых спор у этих грибов происходит в специальных структурах: у аскоспор – в асках (сумках); у базидиоспор – на (в) плодовых телах.
У представителей класса Zygomycetes продуктом полового процесса, представляющего собой слияние коротких боковых ответвлений вегетативных гифов, являются одноклеточные образования – зигоспоры. Весь жизненный цикл несовершенных грибов (Fungi imperfecti) проходит в гаплоидной стадии. Они размножаются только бесполым путем.

Рис. 16. Морфология грибов рода Rhizopus, класс Zygomycetes
Вирусы не способны к росту и бинарному делению, их размножение тесно связано с клеткой-хозяином. Процесс взаимодействия вирусов с чувствительной клеткой называется репродукцией. Выделяют раннюю и позднюю ее фазы. Ранняя фаза включает: 1) адсорбцию вириона на чувствительной клетке; 2) проникновение в клетку (пенетрацию); 3) раздевание вириона.
Начальные процессы адсорбции имеют неспецифический характер, в их основе может лежать электрическое взаимодействие положительно и отрицательно заряженных группировок на поверхности вируса и клетки. На адсорбцию влияют также рН, буферность и температура среды. При температуре 4 °C адсорбция носит синхронный характер, с повышением температуры скорость адсорбции увеличивается, но она приобретает асинхронный характер. Дальнейшее взаимодействие клеточных рецепторов и вирусных прикрепительных белков носит специфический характер.
Вирусы используют рецепторы, предназначенные для проникновения в клетку необходимых для ее жизнедеятельности веществ: гормонов, ферментов, факторов роста, других питательных веществ. Клеточные рецепторы имеют разную химическую природу. Так, для вируса гриппа и парагриппа рецепторами являются структуры, содержащие сиаловую (нейраминовую) кислоту.
Прикрепление вириона к клеточной поверхности осуществляется следующим образом. Вначале происходит образование единичной связи прикрепительного белка с рецептором – обратимая адсорбция. В этот момент, изменяя рН среды, воздействуя ультразвуком, антителами, можно удалить вирион с поверхности клетки. Для того чтобы наступила необратимая адсорбция, должны появиться множественные связи между вирионами и клеточными рецепторами. Число молекул клеточных рецепторов, участвующих в адсорбции, может доходить до 3000.
Прикрепительные белки вирусов могут находиться в составе уникальных образований, таких, как фибры у аденовирусов. У сложно организованных вирусов эти белки входят в состав шипов на поверхности суперкапсиды, например, у вируса гриппа имеется 300 – 450 шипов гемагглютинина. Просто организованные вирусы содержат прикрепительные белки в составе капсида.
Проникновение (пенетрация) вирусов в клетку осуществляется за счет двух механизмов, взаимодополняющих друг друга: виропексиса (эндоцитоза) и слияния вирусной и клеточной мембраны.
Термин «виропексис», предложенный в 1948 г. Фазекасом де Сан Гро, означает, что вирион попадает в цитоплазму в результате инвагинации участка плазматической мембраны и образования вакуоли. Виропексис является частным случаем рецепторного эндоцитоза, который обеспечивает поступление в клетку аминокислот, нуклеотидов, гормонов и других веществ из межклеточной жидкости. Большинство вирусов проникает в клетку путем рецепторного эндоцитоза, некоторые вирусы – за счет механизма слияния. Функцию белка слияния у вируса гриппа выполняет малая гемагглютинирующая субъединица HA2, у вирусов парагриппа белок слияния — fusion protein (англ. fusiоn – слияние).
Раздевание вируса происходит параллельно с его проникновением. В результате раздевания освобождается внутренний компонент вируса, способный вызвать инфекционный процесс. Раздевание вириона осуществляют ферменты клетки – липазы и протеазы и сопровождается рядом характерных особенностей: вирион теряет инфекционную активность, появляется чувствительность к нуклеазам, возникает устойчивость к нейтрализующему действию антител и др. Раздевание вириона осуществляется постепенно. Так, вирус гриппа вначале теряет липопротеиновую оболочку, на втором этапе удаляется М-белок и освобождается нуклеокапсид.
Прионы присоединяются к внешней поверхности мембраны N-терминальной последовательностью и путем эндоцитоза проникают в клетку. Для накопления PrPSc в клетке необходим нормальный PrPC. Животным, лишенным гена PRNP, не передается прионная инфекция, при увеличении же количества молекул белка PrP возрастает вероятность перехода какой-нибудь из них в патогенную форму. Пониженная инфекционность «чужого» приона при межвидовом заражении объясняется, по всей вероятности, сниженной способностью белка PrPSc передавать свое патогенное состояние белку PrPC, несколько отличающемуся от него по первичной структуре. Белок PrPSc в клетке вызывает преобразование PrPC в патологическую изоформу за счет изменения конформации с разрушением альфа-спиралей и образованием бета-тяжей, возможно, с участием пока не идентифицированного белка, который может взаимодействовать с PrPC и стимулировать его превращение (такие белки называют шаперонами). Под влиянием одной молекулы PrPSc происходит трансформация одной молекулы PrPC в ее инфекционную форму PrPSc, далее процесс накопления инфекционного белка носит лавинообразный характер (рис. 17). Эффективность трансформации определяется видовой гомологией PrPC и PrPSc и, следовательно, снижается в условиях гетерологичной системы животное – человек.
Белок PrPC синтезируется в эндоплазматической сети и быстро расщепляется К-протеазой, период его полураспада составляет 5 – 6 ч. Синтезированный PrPC проходит через аппарат Гольджи на поверхность клетки и связывается с гликозилфосфатидилинозитолом. Далее он переносится вдоль аксона при помощи быстрого антероградного транспорта.

Рис. 17. Процесс накопления молекул инфекционного прионного белка
Патологический белок более устойчив к клеточным протеазам и избегает клеточного метаболизма, накапливаясь в структурах лизосом и аппарата Гольджи. Повреждение лизосом вызывает аутокатализ нейрона, после гибели которого PrPSc заражает соседние клетки и откладывается в амилоидных бляшках. Накопление PrPSc всинаптических структурах и связанная с этим дезорганизация синапсов часто являются причиной развития неврологических нарушений и деменции.
Глава 4 СИСТЕМАТИКА МИКРООРГАНИЗМОВ
Систематика занимается всесторонним описанием видов микроорганизмов, выяснением родственных отношений между ними, объединением их во взаимосвязанные и взаимоподчиненные группы (таксоны) и, в итоге, составлением естественной классификации микроорганизмов. Таксономия (от греч. taxis – расположение по порядку) является теорией систематики. Оба термина используются как равнозначные. Систематика состоит из трех частей: 1) номенклатуры (правил присвоения названий таксонам и список этих названий); 2) классификации (распределения микроорганизмов по таксономическим группам); 3) идентификации (определения вида бактерий).
Международный комитет по систематике бактерий издает «Международный кодекс номенклатуры бактерий», «Список одобренных названий бактерий» и «Дополнения» к нему.
Микробиология как наука возникла раньше, чем генетика. Поэтому систематика бактерий базировалась исключительно на изучении их фенотипических признаков. На основе методов феносистематики сформировалась традиционная классификация бактерий. Феносистематика изучает таксономические признаки микроорганизмов, т. е. любые признаки, по которым можно установить сходство и отличие классифицируемых групп микроорганизмов.
К таксономическим признакам относятся:
• морфология бактерий;
• подвижность;
• спорообразование;
• культуральные особенности;
• тинкториальные свойства (отношение к окраске по Граму);
• физиологические свойства (типы метаболизма, спектры ферментации или утилизации субстратов, отношение к кислороду);
• антигенная структура микроорганизмов;
• химический состав бактерий (жирнокислотный и липидный состав, белковые спектры и др.);
• чувствительность к бактериофагам и антибиотикам.
Вместе с тем феносистематика имеет ряд существенных недостатков:
• субъективность выбора изучаемых признаков и их оценки;
• зависимость проявления признаков от условий их изучения (фенотипическая изменчивость);
• малая информативность (фенотипически проявляется 5 – 20 % информации генома).
Для повышения информативности и объективности исследования в конце XX в. была создана численная (нумерическая) таксономия. В настоящее время она реализуется на основе компьютерных технологий и должна отвечать двум требованиям: признанию всех таксономических признаков равноценными и изучению максимально большого числа признаков.
Это позволяет применить математический подход к выявлению таксонов и устанавливать степень родства между ними по количественным показателям. Числовая таксономия применяется в научных исследованиях, а в практической работе проводят идентификацию микроорганизмов по ограниченному набору (20 – 30) ключевых таксономических признаков.
Более объективной является естественная (филогенетическая) классификация бактерий, основанная на методах геносистематики. Фенотип и генотип – неразрывные составляющие организма как целого, поэтому методы фено- и геносистематики тесно взаимосвязаны. Геносистематика изучает организацию геномов, т. е. генетические программы организмов. Объект ее исследования – ДНК клетки. Первый метод геносистематики, разработанный в 1957 г. отечественными учеными А. Н. Белозерским и А. С. Спириным и сотрудниками Института Пастера в Париже (К. Ли, Р. Вейлем, Е. Барбю), состоял в определении гуанин-цитозинового коэффициента (соотношения молярных процентов гуанина и цитозина) нуклеотидного состава суммарной ДНК микроорганизма по температуре плавления ДНК или спектрофотометрически. В настоящее время в геносистематике используются методы, позволяющие выявлять родство микроорганизмов на различных таксономических уровнях и изучать их эволюционные связи. К методам генетического анализа относятся:
1. Молекулярная гибридизация ДНК-ДНК (метод выявления гомологии ДНК) позволяет выявить родство на уровне вида и рода. При степени гомологии 70 % и более бактерий относятся к одному геновиду.
2. Молекулярная гибридизация ДНК с рибосомной РНК выявляет родство на уровне рода, семейства.
3. Секвенирование ДНК – определение нуклеотидной последовательности генов или фрагментов (олигонуклеотидов) ДНК позволяет выявлять эволюционные связи на уровне царства, отдела, класса, семейства, рода, но недостаточно чувствителен на уровне вида.
4. Рестрикционный анализ ДНК («фингерпринтинг») позволяет осуществлять внутривидовое типирование бактерий.
4.1. Классификация бактерий
Согласно «Международному кодексу номенклатуры бактерий», научным языком является латинский. Таксономические категории подразделяются на обязательные и необязательные.
Необязательные таксоны (по убывающей):
• подкласс;
• подсемейство;
• триба;
• подтриба;
• подрод;
• подвид.
Обязательные таксоны (по убывающей):
• домен;
• царство;
• тип;
• класс;
• отдел;
• порядок;
• семейство;
• род;
• вид.
Род обозначается одним словом с прописной буквы (существительным в единственном числе); вид – бинарной комбинацией, состоящей из названия рода (с прописной буквы) и видового эпитета (со строчной буквы). При первом упоминании в тексте приводится полное название вида. При повторном употреблении родовое слово сокращается до первой буквы, видовой эпитет сохраняется полностью, например Yersinia pestis и Y. pestis. Видовой эпитет дается произвольно, но чаще по происхождению вида, его особому свойству или в честь ученого, описавшего вид. Обычно видовой эпитет – существительное в родительном падеже, например Shigella sonnei.
Вид может иметь подвиды. Для их обозначения используется тройная комбинация, состоящая из названия рода, видового и подвидового эпитетов. Для разграничения видового и подвидового эпитетов перед последним ставится сокращенное слово subsp. (от лат. subspecies – подвид), например Klebsiella pneumoniae subsp. ozenae. Вид также может иметь разновидности (варианты или вары): серовары, биовары, хемовары и др., например: Salmonella enterica серовар Typhi или S. Typhi. Микроорганизмы одного вида, полученные из различных источников или в разное время, называют штаммами. Им присваивают протокольный номер или номер по источнику выделения. Термином клон обозначают культуру микроорганизмов, полученную из одной клетки. Чистая культура – это популяция микроорганизмов, состоящая из особей одного вида.
Перечень названий всех изученных (опубликованных) видов бактерий представлен в издании Международного комитета по систематике бактерий. В микробиологии до сих пор нет четкого, общепринятого определения такой важнейшей таксономической категории, как вид бактерий. Это обусловлено отсутствием надежных критериев вида у прокариотов. Критерии, используемые для определения вида у растений и животных, не пригодны для бактерий. Можно сказать, что под видом следует подразумевать условную группу микроорганизмов, одинаковых по своим фенотипическим и генотипическим свойствам.
В 1923 г. английский микробиолог Д. Берджи создал первый «Определитель бактерий». Классификация бактерий постоянно совершенствуется, что находит отражение в периодических изданиях «Определителя бактерий».
Среди клеточных форм жизни различают три домена: бактерии, архебактерии (не представляют интереса для медицинской микробиологии) и грибы-эукариоты.
В домен бактерий входят микоплазмы (бактерии, не имеющие клеточной стенки), бактерии с тонкой (грамотрицательные) и толстой (грамположительные) клеточной стенкой. Значение в патологии человека имеют только следующие типы бактерий.
Тип протеобактерий. Класс альфа-бактерий, роды Bartonella, Brucella, Ehrlichia, Orientia, Rickettsia. Класс бета-бактерий, роды Alcaligenes, Bordetella, Burkholderia, Kingella, Neisseria, Spirillum. Класс гамма-бактерий, роды Acinetobacter, Callimatobacterium, Citrobacter, Coxiella, Edwardsiella, Ervinia, Escherichia, Hafnia, Klebsiella, Francisella, Legionella, Pseudomonas, Moraxella, Vibrio, Enterobacter, Morganella, Proteus, Providentia, Salmonella, Serratia, Shigella, Yersinia, Pasteurella. Класс дельта-бактерий, род Bilophila. Класс эпсилон-бактерий, роды Campylobacter, Helicobacter, Wolinella.
Тип фирмикутов. Класс клостридий, роды Clostridium, Sarcina, Peptostreptococcus, Eubacterium, Peptococcus, Veilonella. Класс молликутов, роды Mycoplasma, Ureaplasma. Класс бацилл, роды Bacillus, Sporosarcina, Listeria, Staphylococcus, Gemella, Lactobacillus, Pediococcus, Aerococcus, Leuconostoc, Streptococcus, Lactococcus.
Тип актинобактерий. Класс актинобактерий, роды Actinomyces, Arcanobacterium, Mobiluncus, Micrococcus, Rothia, Stomatococcus, Corynebacterium, Mycobacterium, Nocardia, Propionibacterium, Bifidumbacterium, Gardnerella.
Тип хламидий. Класс хламидий, роды Chlamydia, Chlamydophila.
Тип спирохет. Класс спирохет, роды Spirochaeta, Borrelia, Treponema, Leptospira.
Тип бактероидов. Класс бактероидов, роды Bacteroides, Porphyromonas, Prevotella. Класс флавобактерий, род Flavobacterium.
4.2. Классификация грибов
Классификация грибов до настоящего времени остается несовершенной и незавершенной. Ранее грибы считали организмами, ближе всех стоящими к растениям, и классифицировали как низшие растения. Основные таксоны, включающие группы грибов, назывались отделами. Большинство грибов, имеющих медицинское значение, относили к формальному отделу Fungi imperfecti. При обнаружении половой стадии развития этих грибов их относили к одному из отделов совершенных грибов (Ascomycota или Basidiomycоtа). Mногие авторы до сих пор придерживаются этой системы классификации грибов.
Достижения последних лет в области молекулярной генетики показали, что «родственные связи» между грибами установить крайне сложно. Царство Mycota объединяет две группы организмов: грибоподобные протоктисты и истинные грибы. Первая группа представлена следующими отделами: Myxomycota, Plasmadiophoromycota, Labyrinthulomycota, Oomycota, Hyphochytriomycota, Chytridiomycota. Вторая группа представлена отделами: Zygomycota, Ascomycota и Basidiomycota, а также «несовершенными грибами». К этой группе относится большинство патогенных и условно-патогенных грибов. Внутри отделов грибы, согласно классификации, разделены на классы, порядки, семейства. Грибы относятся к порядку Actinomycetales, семейству Actinomycetaceae. Отдел Zygomycota включает лишь единичных возбудителей микозов (мукороза и энтомофтороза). Представители отделов Ascomycota и Basidiomycota являются возбудителями микозов, относящихся к III и IV группам патогенности. Ряд представителей диморфных грибов, например Coccidioides immitis, относятся ко II группе патогенности, так как они способны вызывать системные заболевания человека. Такой же уровень биологической опасности имеют некоторые возбудители феогифомикоза (Cladophialophora bantiana),