Раздел 1. Теоретические выкладки
Глава 1. История атомизма
Всё состоит из частиц… вещи отличаются друг от друга частицами, из которых состоят, их порядком и расположением…
Квантовый мир элементарных частиц и атомного ядра удивителен по своей красоте, структуре и масштабам. И далее также будет рассмотрен этот мир во всех сложностях. Но первоначально необходимо понять саму суть первых шагов в открытии атома, той самой частички с которой всё и начиналось. Первая глава кардинально отличается от остальных глав поскольку она создана специально не только для высших умов, которые уже оперируют с довольно сложными понятиями, но и для юного поколения, только вступающего на путь этой удивительной науки. Поэтому в этой главе всё описано максимально просто и элементарно. Итак, без лишних слов, история величайшей атомной науки начинается…
С самых древних времён люди пытались определить структуру нашего мира, понять из чего же он состоит. Изначально, все эти вопросы были чисто философскими, по этой причине возникло такое понятие как атомизм, по этой теории, все вещества, объекты, тела состояли из неделимых частиц – атомов. Эта идея широко поддерживалась ещё в древности, впервые появившись в самых различных точках нашей планеты от древней Индии до Древней Греции и Восточного мира.
К примеру, в Древней Греции атомизм широко поддерживался также и Демокритом Абдерским, Левкиппом и другими. Противники идей атомизма могли лишь утверждать, что материя делится до бесконечности. Также учение Демокрита было основано и на идее того, что атомы не только неделимы, но их количество бесконечно, они не сотворены, и они вечны, а свойства объектов зависят от атомов. Большой вклад в идею атомизма внёс также, и философ Эпикур, а уже позже поэт Лукреций. Но если с утверждением самого понятия атома всё было ясно, поскольку атом переводится с древнегреческого как «неделимый», то есть атомы не могли делится, то с их формами были проблемы. Впервые идею о формах атома выдвинул Платон, предположив, что атомы имеют формы Платоновских тел или правильных многогранников как куб, пирамида, тетраэдр, додекаэдр, октаэдр и другие, то есть многогранники, грани которых равны между собой. Большого внимания атомизм заслужил после активных ссылок на эту идею самого Аристотеля, после чего эта идея начала распространяться по всему миру.
В восточном же мире, где выдающиеся мыслители и гении проводили свои исследования и совершали великолепные исследования в академии Маъмуна были также отдельные мнения на тему атомизма. В самой академии Маъмуна проводили свои эксперименты такие выдающиеся учёные как Абу Райхан Бируни, ибн Сина, Абу Наср ибн Ирак, Махмуд Худжанди, Ахмад ибн Мухаммад Хорезми, Ахмад ибн Хамид Найсабури и многие другие. Многие из них являются выдающимися учёными, если Абу Али ибн Хусейн ибн Абдаллах ибн Сина, также известный как ибн Сина или Авиценна в Европе создал «Канон врачебной науки и считается отцом медицины, то Абу Райхан Бируни – учёный-энциклопедист, который проводил исследования в области физики, математики, астрономии, естественных наук, истории, хронологии, лингвистики, индологии, наук о Земле, географии, философии, картографии, антропологии, астрологии, химии, медицины, психологии, богословия, фармакологии, истории религии и минералогии. Также он считается создателем первого глобуса, также первый человек измеривший радиус планеты используя тригонометрические закономерности, а также первым кто, предсказал наличие материка Америки.
На сегодняшний день сохранились письма Абу Райхана Бируни и ибн Сины, вместе с их трудами, где учёные вели дебаты также по теме строения материи. По предположению учёных, мир состоял из частиц меньшими чем атом, именно там можно увидеть предположения, что и считавшаяся тогда неделимой частица атома делима, но не до бесконечности. Что же касается их формы, то тогда велись предположения, что атомы имеют сферическую форму, поскольку сфера считалась некой идеальной моделью, следовательно, атомы должны быть такими.
Проходит время и делаются самые различные открытия. Но про идеи Эпикура, впрочем, как и про атомизм забывают, поскольку идеи Эпикура противоречили христианским учениям и церковь запрещала её использование, как и утверждение того, что атомы существуют. Но французский католический священник Пьер Гассенди возродил идею атомизма, несколько изменив понятие того, что атомы были созданы Богом. А уже после защиты атомизма со стороны химика Роберта Бойля – выдающегося химика и автора труда «Скептический химик», а также со стороны сэра Исаака Ньютона, который сам по себе почитался как выдающийся учёный, атомизм был принят к концу 17 века.
Приведём цитаты самого сэра Ньютона на эту тему из перевода его трудов: «Мне представляется, что Бог с самого начала сотворил вещество в виде твёрдых, весомых, непроницаемых, подвижных частиц и что этим частицам он придал такие размеры, такую форму и такие другие свойства и создал их в таких относительных количествах, как ему нужно было для той цели, для которой он их сотворил. Эти первичные частицы абсолютно тверды: они неизмеримо более тверды, чем те тела, которые из них состоят, – настолько тверды, что они никогда не изнашиваются и не разбиваются вдребезги, так как нет такой силы, которая могла бы разделить на части то, что сам Бог создал неразделимым и целым в первый день творения. Именно потому, что сами частицы остаются целыми и неизменными, они могут образовывать тела, обладающие той же самой природой и тем же строением во веки веков; ведь если бы частицы изнашивались или разбивались на части, то зависящая от них природа вещей изменилась бы. Вода и земля, составленные из старых, изношенных частиц и осколков, отличались бы по строению и свойствам от воды и земли, построенных из ещё целых частиц в начале творения. Поэтому, для того чтобы природа могла быть долговечной, все изменения тел природы могут заключаться лишь в перемене расположения, в образовании новых комбинаций и в движений этих вечных частиц… Бог мог создать частицы вещества обладающими разными размерами и может разной формой, поместить их на разных расстояниях друг от друга, наделить их, быть может, разными плотностями и разными действующими силами. Во всём этом я, по крайней мере, не вижу никаких противоречий… Итак, по-видимому, все тела были построены из вышеупомянутых твердых непроницаемых частиц, которые были в первый день творения размещены в пространстве по указанию Божьего разума».
И если тогда были установлены идеи Бойля о том, что существуют «простые тела» (химические элементы) и «совершенные смеси» (химические соединения) и любые «совершенные смеси» можно разделить на «простые тела», то в книге «Новая система химической философии» 1808 года, Джон Дальтон выдвинул первую мысль о том, что из веществ, к какому виду подлежит. Но перед этим, Лавуазье доказал, что масса постоянна, она никуда не исчезает и не появляется из ниоткуда. Также Дэви открыл целый ряд химических элементов: водород, кислород, азот, углерод, сера, фосфор, натрий и калий были открыты им в 1807 году, а уже в 1808 году им же были открыты такие элементы как кальций, стронций, барий и магний. Также были открыты железо, цинк, медь, свинец, серебро, платина, золото и ртуть.
Их открытие не заняло большего труда, поскольку многие из них выделялись из руд, выделялись из химических соединений. А уже вода, аммиак, углекислый газ и многие другие соединения считались уже совершенными смесями. И теперь, Дальтон располагая всем необходимым, решил определить атомные массы всех химических элементов, а также ввести их все в таблицы, то есть классифицировать. Итак, Дальтон ввёл для каждого химического элемента своё обозначение, к примеру, для водорода он ввёл значок круга с точкой в центре, для кислорода был свой знак – обычный круг, а для углерода был знак закрашенного чёрного круга и т. д. Чтобы вычислить массы атомов, Дальтон провёл некоторые эксперименты.
Изначально, он выпаривал воду, а на верхней части устанавливал вещества с которыми лучше реагировал водород, вычислив изменения как в массе вещества, с которым происходило взаимодействие или от объёма пара, Дальтон мог определить какая часть воды состоит из водорода, а какая из кислорода. Таким образом определив, что 1/8 часть от всей массы воды состоит из водорода, а 7/8 из кислорода, Дальтон решил, что кислород тяжелее водорода и присвоил водороду массу, равную 1, а кислороду 7. Такой же анализ аммиака показал для водорода 1, а для азота 5. Именно так проанализировав, Дальтон составил собственную таблицу химических элементов.
Стоит ли говорить, что хоть это и было первым шагом на пути познания, все эти утверждения были не верными. Но она держалась довольно долго и на её основе строились различные предположения. Одна из таких гипотез была опубликована в журнале «Философские анналы» со стороны лондонского врача Уильяма Праута и была посвящена идее того, что все атомы состоят из водорода. Но конечно, эта гипотеза была не верной как многие другие, предположения того времени.
И если тогда, атомная единица массы была взята как масса атома водорода, то сегодня точной единицей, считается 1/12 часть массы атома углерода и названа как а. е. м. или атомная единица массы. А химические элементы сегодня принято обозначать от первых двух или одной буквы их названия на латыни, к примеру, водород обозначается как H благодаря названию Hydrogenium («Порождающий воду» на латыни), Азот – N или Nitrogenium – «Рождающий селитру», железо – Fe или Ferrum, медь – Cu – Cuprum, углерод – C – Carboneum. Эта система была принята 3 сентября 1860 года после того как итальянский химик Станислао Канниццаро на Международном конгрессе в Карлсруэ предложил данной метод на своём выступлении.
После этого, было принято записывать химические соединения при помощи этих символов, а число атомов указывалось в нижнем правом углу, так к примеру соединение углерода и водорода (вода) записывается как H2O, аммиак – NH3, серная кислота H2SO4 и т. д. Данный метод весьма удобен, поскольку создаёт возможности для использования символьной записи и нет необходимости записывать все символы несколько раз, к примеру, для молекулы тростникового сахара – C6H12O6 (6 атомов углерода, 12 атомов водорода и 6 атомов кислорода). Вместо CCCCCCHHHHHHHHHHHHOOOOOO можно легко и просто записать С6Н12О6.
Если с обозначениями уже всё ясно, то остаётся одно очень интересное следствие. При учёте того, что 1 атомная единица массы равняется 1/12 атома углерода, то это даёт возможность вычислить массы всех химических элементов используя соединения с углеродом. Для лучшего объяснения, приведём пример. Пусть имеется некоторое соединение углерода и водорода, если воздействовать на его при помощи электрического тока или нагревать его, то можно, если оно твёрдое расплавить, если жидкое выпарить и получить конечный объём углерода и водорода. Из соотношения их масс и объёмов, можно определить сколько атомов водорода приходится на один атом углерода, а уже из соотношения их масс, можно вычислить массу водорода. Так если разделить соединение метан на составляющий углерод и водород, то получается в 4 раза больше, в объёме, водорода, чем углерода, благодаря чему можно сделать вывод, что на 1 атом углерода, приходится 4 атома водорода и получается соединение CH4. А что касаемо масс, то в данном соотношении получается, что масса 1 атома водорода равна почти 1/12 массы атома углерода или 1,00811 а. е. м. Ровно таким же методом можно определить массы для всех остальных атомов (Табл. 1.1).









Но чему же точно равняется это значение в 1 а. е. м.? Если ответить на этот вопрос, то можно найти массы всех остальных типов атомов, заодно доказать их реальность. Но ни один из атомов, даже самый большой из них невозможно увидеть ни в каком микроскопе на тот момент. Положение спасает открытие, сделанное в 1828 году английским ботаником Робертом Броуном. Когда Роберту Броуну привезли новый микроскоп, он оставил его в саду, а на утро, на «столике» микроскопа образовались капли росы, а сам Броун забыл их протереть и автоматически посмотрел в микроскоп. Какое же было его удивление, когда он увидел, что частички пыльцы, находящиеся в капле росы хаотично двигаются. Частицы не живые и не могут двигаться сами по себе. Этого просто не могло быть. Но затем, когда это движение было зафиксировано появились некоторые предположения и гипотезы, объясняющие это явление.
Возможно, это движение объяснялось тем, что в самой капле имеются потоки из-за разности давлений и температур, как к примеру, движение пылинок в воздухе. Ведь если такое движение есть у микроскопических объектов, значит оно должно быть и у частиц с большим размером, как у пылинок. Ведь движение пылинок объясняется именно потоками воздуха. Но эта идея не подтвердилась, потому что частицы не двигались в одном направлении. Ведь в потоке или течении струи воздуха, воды или другой среды, частицы должны двигаться только в одном направлении, а движение микроскопических частиц в броуновском движении, не зависит друг от друга.
В таком случае, возможно это движение результат окружающей среды? От внешних звуков, сотрясений стола и других объектов? Это утверждение опроверг уже французский физик Гуи. Проведя ряд экспериментов, он сравнил хаотичное броуновское движение с движением в глухом подвале в деревне с движением посреди шумной улицы. Движения, конечно сказывались, но сказывались только на всей капле целиком, а не на самом броуновском движении частиц. Притом, такое же движение было и в газах, как и в жидкостях, ярким примером такого движения являются движения частичек угля в табачном дыме. Для визуального примера можно сравнить две картины. То как образуется и расплывается табачный дым в воздухе и картина в воде, после того как в неё капнуть каплю краски или красителя.
Объяснение всему этому даёт Карбонель, именно он объясняет, что частицы попадают под толчки со всех сторон, что и вызывает их такое хаотичное движение. И чем частицы меньше, тем их движение становится активнее, поскольку толчки отбрасывают их всё сильнее, а если тела большие, то и число толчков со всех сторон так или иначе становится почти равным, поэтому мебель, здания и сами люди не вибрируют сами по себе и не наблюдается броуновского движения. Также выясняется, что насколько температура больше, настолько больше и скорость этих частиц.
Эта картина становится ещё более ясной, когда Рихард Зигмонди, удалось изобрести свой ультрамикроскоп, на основе которого уже можно было увидеть ещё более мелкие частицы. И их движение уже не было простым движением, это было мельканием, прыганьем и всплеском, описал бы сам Зигмонди. Но чтобы лучше разглядеть эту картину, помог метод Сведберга, который уменьшал время прохода света в микроскоп, благодаря чему удавалось зафиксировать именно точно указываемый момент, то есть можно было сфотографировать это движение. И при уменьшении промежутка времени, делая всё меньше и меньше, стало возможно дойти до того момента, когда частицы на фотографии просто застывали на месте.
И наконец, настаёт 1908 год, когда окончательно было установлено, что атомы существуют, имеют массу и являются основными единицами вещества, а соединяясь друг с другом образуют молекулы – частички любого сложного соединения, будь то вода, кислота, человеческое тело и т. д.
Итак, Жан Перрен – французский физик решает изучить атомы и находит очень даже удивительный способ сделать это. Он берёт каплю «гуммигута», кусочки резиновой смолы или жёлтой краски, если угодно. Растерев этот кусок в воде как кусок мыла, он получал желтоватую воду. Но когда он брал каплю и рассматривал её в микроскоп, то получалось, что гуммигут не совсем пропал, а просто разделился на тысячи и тысячи мелких частичек разных размеров. Перрен решил, что если они разных размеров и все это гуммигутовые частички, значит имеют различные массы, следовательно, их можно отделить использовав центрифугу. То есть если вращать эту жидкость, то более тяжёлые частички логично отделят к стенке, а более лёгкие останутся.
И с увеличением скорости сила увеличивается не дважды, а во столько же раз, во сколько увеличилась скорость, из-за второй степени в формуле центростремительного ускорения. Следовательно, господин Перрен, легко мог утверждать, что может отделить сильным вращением тяжелые частички от лёгких и использовал он для этого центрифугу, тот самый аппарат, который не расплёскивая всю жидкость вращал с определённой частотой. Перрен использовал центрифугу, которая таким образом вращалась 2500 раз в минуту. И даже тогда лишь в маленькой части центра образовывались места с однородными частичками, а остальные отлетали к краям. Поэтому господину Перрену приходилось по нескольку раз так использовать центрифугу. Даже с учётом того, что эта центробежная сила, даже на радиусе в 15 см, уже превосходила силу тяжести (силу притяжения Земли) в 1 000 раз. В чём можно убедиться, учитывая, что сила тяжести определяется произведением (умножением) массы на ускорение падения любого объекта g, которое одинаково для всех объектов и равняется 9,81 м/с2 (метров в секунду в квадрате). А исходя из того, что совершается 2500 оборотов в минуту, можно вычислить, что угловое ускорение по (1.1).

Остаётся лишь вычислить отношение и получить результат (1.2).

Получаемое число действительно больше 1 000, то есть сила на расстоянии всего 15 см уже больше силы притяжении всей планеты в 1 046,9 раз. Таким образом, в конце концов, Перрену удалось получить воду только с указанными диаметром частиц – 0,5 (5 из 10 частей), 0,46, 0,37, 0,21 и 0,14 микрона (1 тысячная доля миллиметра или 10—6 м, что соответствует делению 1/1000000). Ну и наконец, получив такие жидкости только с определённым типом частиц гуммигута (такие жидкости называются эмульсиями), Перрен решил поэкспериментировать и понаблюдать за ними в микроскопе. Наблюдая за ними повернув всю кюветку на бок, Перрен заметил, что эти частички уменьшаются с увеличением высоты. Если вначале они заполняли равномерно или хаотично всю жидкость, то затем они уменьшались с высотой, ровно также как уменьшается воздух в верхних слоях атмосферы. А это уже была мысль! Если это сравнить с уменьшением воздуха на больших высотах, то можно установить закономерность. Но чтобы это проверить Перрен решил сосчитать эти зёрнышки на каждой высоте.
Увы, фотографировать их не получалось, ведь фотографии получались слишком не чёткие из-за малого размера в менее чем 0,5 микрон и Перрен по нескольку раз измерял число частиц гуммигута на разной высоте, поскольку частички двигались, не получалось точного подсчёта, поэтому Перрену приходилось даже на одной высоте считать несколько раз, а потом говорить среднее число. Так в один раз, он провёл расчёт на высоте 5, 35, 65 и 95 микрон. И получалось, что число частиц на высоте 35 микрон было равно почти половине числа частиц на высоте 5 микрон, а высоте 65 – половине 35 и т. д. А это уже прекрасно попадало под закон уменьшение атмосферного давления (силы давления кислорода на нашу планету) с высотой, которую ещё 17 столетии определил Блез Паскаль, знаменитый французский учёный. Он измерял количество кислорода, при помощи барометра Торричелли, устройства для измерения давления, принцип которой состоит в том, что при нормальном давлении воздуха сверху, ртуть в трубке находится на определённой высоте, когда давление становится меньше, ртуть может подниматься, а если давление увеличивается, то наоборот – спадает, если же давления нет, как и притяжения – то это некое подобие невесомости. Вычислив разницу в слоях атмосферы, Паскаль ещё тогда определил, что кислород уменьшается с увеличением высоты на каждые 5 км. Но почему здесь уменьшение частиц гуммигута в 2 раза только с 5 до 35, а в атмосфере с 5 до 10, даже если не учесть масштабы?
А всё дело в частицах, ведь в атмосфере – кислород, а здесь частички гуммигута, насколько причём большие, что их можно увидеть в микроскоп, их диаметр 0,21 микрон. Также закон изменяется и для азота, и для углекислого газа и т. д. из-за разности масс молекул. И если считать э4ту эмульсию как маленькую атмосферу, то уже можно вычислить настоящую массу атома! Проделать этот расчёт не так уж и сложно, высота, на которой плотность кислорода становится в 2 раза меньше – 5 км, а для гуммигута – 30 микрон. А 5 км в 165 000 000 раз больше, чем 30 микрон, следовательно, 1 такой шарик гуммигута с диаметров в 0,21 микрона в 165 000 000 раз больше молекулы воздуха. А подсчитать массу этого гуммигутового шарика проще простого.
Отношение массы 1 кубического метра гуммигута (в объёме куба с размерами в 1 метр ширины, 1 метр высоты и 1 метр длины) на его массу, такое же, как и у этого шарика гуммигута и равно 1 000 кг/м3 (килограмм на кубический метр) или 103 кг/м3 (10 в кубе). А объём сферы для шарика гуммигута, также находится просто. Ведь для того, чтобы вычислить объём сферы, необходимо круг прокружить в пространстве, то есть умножить на его площадь, площадь второго круга и тогда получится и заодно вычесть ту часть круга, где такой «оборот» прошёлся 2 раза. В итоге получается формула, выводимая наподобие формулы для площади круга (1.3).

Такой объём соответствует массе, с учётом силы Архимеда, то есть силой, которая выталкивает из воды, поскольку частички гуммигута находятся в воде, а не в воздухе составляет примерно 10—14 грамм. И если это зерно больше молекулы кислорода в 165 миллионов раз, следовательно, масса атома кислорода составляет 5,33*10—23 грамм. А это уже, как можно узнать из сравнений масс водорода и кислорода (с учётом, что в молекуле кислорода 2 атома, поскольку это газ) в 32 раза больше чем масса водорода, следовательно, масса атома водорода составляет 1,674*10—27 кг, то есть в 1 грамме водорода уже содержится 597 371 565 113 500 597 371 565 114 атомов водорода! И так, можно было уже сравнивать массу атома с а. е. м., получив, что масса атома водорода составляет 1,007825 а. е. м. Именно таким образом Перрен смог сделать казалось бы невозможное – взвесить атомы и молекулы и теперь атомы и молекулы были не сказкой, а настоящей наукой с точными расчётами, формулами и указаниями!
И даже Освальд, ярый противник атомистической теории, в предисловии к своему курсу химии написал: «Теперь я убеждён, что в последнее время мы получили опытное доказательство прерывного, или зернистого, строения материи – доказательство, которого тщетно искала атомистическая гипотеза в продолжении сотен и тысяч лет. Совпадение броуновского движения с требованиями этой гипотезы даёт право самому острожному учёному говорить об опытном доказательстве атомистической теории вещества. Атомистическая гипотеза сделалась, таким образом, научной, прочно обоснованной теорией».
И наконец, можно было смело утверждать, что всё в этой вселенной от планет и звёзд, до нас с Вами, до всего, что видит глаз состоит из атомов, но насколько верным было это утверждение? И возможно, учёным предстояло найти и другие частицы…
Изображения к 1 главе

Рис. 1.1. Демокрит – один из первых авторов идеи атомизма

Рис. 1.2. Левкипп – один из первых людей, поддержавших и развивавших атомизм

Рис. 1.3. Эпикур – философ, вложивший большой вклад в теорию атомизма

Рис. 1.4. Платон – предполагал, что атомы имеют формы платоновских тел

Рис. 1.5. Абу Райхан Беруни – являлся сторонником атомизма и полагал, что атом также делим, но не бесконечно

Рис. 1.6. Абу Али ибн Хусейн ибн Абдаллах ибн Сина – также известен как Авиценна, сторонник теории атомизма

Рис. 1.7. Пьер Гассенди – возродил идею атомизма

Рис. 1.8. Роберт Бойль – учёный защитивший атомизм в своей выдающейся работе «Скептический химик»

Рис. 1.9. Исаак Ньютон – великий учёный, также ставший сторонником атомизма

Рис. 1.10. Джон Дальтон – один из первых сторонников возрождения атомизма, а также создатель одной из первых таблиц по классификации

Рис. 1.11. Таблица Дальтона

Рис. 1.12. Уильям Праут – полагал, что всё в мире состоит из водорода

Рис. 1.13. Станислао Канниццаро – предложил обозначать химические элементы их латинскими наименованиями, введя современную символику

Рис. 1.14. Роберт Броун – первооткрыватель Броуновского движения

Рис. 1.15. Периодическая система Дмитрия Ивановича – то, что некогда хотел создать Дальтон

Рис. 1.16. Рихард Зигмонди – изобретатель ультрамикроскопа

Рис. 1.17. Жан Перрен – человек, доказавший существование атомов определив их вес
Глава 2. Внутри атома и особенности ядра
Атом долгое время считали неделимым, само его название означает «неделимый», но со временем, всё же пришлось согласится с тем фактом, что атом делим и имеет структуру, не смотря на то, что прошло достаточно много времени. Описание дальнейших ступеней развития физики атомного ядра и элементарных частиц тесно граничит с разными математическими операциями, подробные описания которых уже не будут приведены, как и многие упрощения к общим теориям, что сильно увеличило бы объём информации, а некоторые «азы» уже были описаны в предыдущей вводной главе. В данной же главе будут описываться явления радиоактивности с использованием анализа при помощи полного математического аппарата.
Мир элементарных частиц, микрообъектов и квантов удивителен по своему строению, образу существования и законам. Познавая структуру материи, неизбежно приходится принять тот факт, что структура любой материи в близи сама по себе представляет собой отдельный мир, как уже говорилось. Сегодня уже широко известна теория атомизма, которая полагала, что все на свете состоит из мельчайших частиц – атомов. И если впервые эти идеи начинались еще со времен Левкиппа, Платона, Аристотеля и многих других ученых древности, во времена которых эти мысли в основном не выходили за пределы философских умозаключений. Впрочем, как во времена таких великих ученых как Абу Райхан Бируни, Абу Али ибн Сина, Аль-Хорезми, Ахмад Аль-Хорезми и других ученых Востока.
Так было даже время, когда атомизм даже был запрещен. И наконец, когда сам сэр Исаак Ньютон наряду с другими учёными защитил эту грандиозную идею, ее начали признавать и начались активные исследования в этой области. Но для полной победы и доказательства действительности существования атомов, нужно было предъявить какие-либо экспериментальные доказательства. Многие ученые как Джон Дальтон, Дмитрий Иванович Менделеев, Жан Перрен и многие другие пытались провести этот эксперимент, пока наконец, Жан Перрен не провел свой эксперимент с гуммигутовой эмульсией. Проведя аналогию изменения числа частичек гуммигута с изменением атмосферного давления по высоте, Перрен смог впервые определить вес атома.
А после того, как атом полностью был признан существующей частицей, начались работы по определению его структуры. И теперь после ряда исследований и экспериментальных подтверждений таких гениальных ученых экспериментаторов и теоретиков как Джон Томпсон, Эрнест Резерфорд, Нильс Бор и многих других была определена структура атома. И сегодня доказано не только при помощи косвенных экспериментов, но и с помощью прямых экспериментальных доказательств, ярким примером которых является сегодня наличие настоящей фотографии атома, что атом имеет четкую и ясную структуру.
Но как же можно прийти к этой структуре? На этом вопросе стоит остановится несколько более подробно. Как известно, все объекты электризуются, обмениваются зарядами, но где же они расположены? Если зарядами обладают все тела, в том числе и диэлектрики (хоть и малыми), следовательно, заряды имеются в структуре вещества. Вещество как уже было доказано состоит из молекул, а те из атомов, следовательно, заряды находятся внутри атомов.
И история открытия структуры атома начинается в 1897 году, когда Джозеф Джон Томпсон открывает электроны, при изучении электрического тока в газах. То есть когда в трубке, в которой имелись два электрода – катод и анод пропускался ток, то катод испускал некоторые лучи, так называемые «катодные лучи», честь точного определения типа этих лучей и принадлежит господину Томпсону, который отклоняя их в магнитном поле, а также ускоряя в электрическом поле, установил, что это ничто иное как некоторые частицы, испускаемые катодом, с отрицательным электрическим зарядом, благодаря чему они и были названы электронами.

Рис. 2.1. Джозеф Джон Томпсон
И последующие изучения привели к выводу, что электроны являются частью атома и когда они вылетают под действием электрического поля, это приводит к превращению атома в ион. Но обычный атом электрически нейтрален, следовательно, чтобы уравновешивать этот заряд в атоме должна быть часть с положительным зарядом. То есть атом состоит из зарядов, которые каким-то образом взаимодействуют. Как представляется это взаимодействие и является ли это взаимодействие объяснением поведения атомов в химических реакциях, в реакциях с поглощением и излучением света с определёнными длинами волн. Ведь атомы вполне могут быть источниками света, тот же разряженный газ излучает свет с определёнными спектрами, на строгих длинах волн и как это объясняется при помощи этих взаимодействий?
Чтобы это объяснить в 1902 году, господин Уильям Томпсон, более известный как Лорд Кельвин, предложил свою модель строение атома, а уже Джон Томпсон её исследовал более подробно, поэтому эта модель известна как модель Томпсонов. Эта модель была популярна до 1904 года и более известна как «модель пудинга с изюмом». По этой модели атом полностью состоит из положительной материи, а внутри неё находятся электроны, свободно перемещаясь. И при помощи этой модели, вполне получалось описывать некоторые результаты.

Рис. 2.2. Уильям Томпсон или Лорд Кельвин

Рис. 2.3. Модель атома водорода по модели Томпсонов
К примеру, можно описать атом водорода. Если представить в такой модели атом водорода, то электрон будет «плавать» в положительном заряде, но его будет тянуть к центру этой положительной «капле», благодаря силе электростатического равновесия. Если допустить, что электрон отходит от центра на некоторый радиус, меньший радиуса самого атома, то его будет притягивает мысленная сфера, образуемая этим радиусом. Но поскольку он заряжен равномерно, то его можно сконцентрировать в центре и просто записать по формуле Кулона (2.1).

А для определения заряда мнимой сферы, образуемой внутри общего большого заряда, можно использовать отношение этой мнимой сферы ко всей сфере, а поскольку заряд общей сферы уже известен и равен с зарядом электрона, чтобы атом был нейтрален, то и получается выражение (2.2), где и выводится заряд мнимой сферы.

И если уже подставить это значение под силу Кулона, получается (2.3), довольно интересное выражение, которое прямо пропорционально расстоянию, на которое отдаляется электрон от центра.

Также для дальнейшего удобства здесь можно ввести понятие, что коэффициент вне радиуса мнимой сферы, это колебательная жёсткость (2.4), а если записывать с этой жёсткостью уже не саму формулу силы Кулона, а его проекцию на радиус мнимой сферы, то получится выражение (2.5), причём отрицательный, за счёт того, что вектор силы и само расстояние (направление электрона) противоположны.

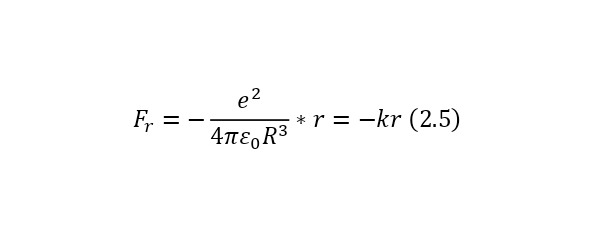
А теперь, если предположить, что электрон таким образом колеблется, то это напоминает конструкцию осциллятора или точнее математического маятника со своей жёсткостью и частотой, определяемой по (2.6).
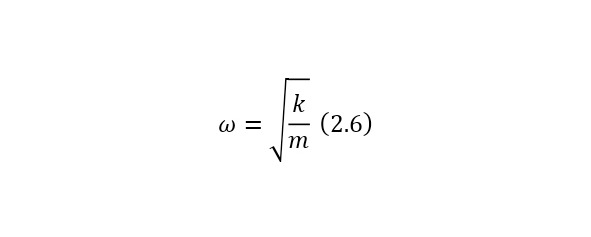
И если подставить под (2.6) необходимую жёсткость, а в качестве массы взять массу электрона, то частота будет иметь порядок оптических волн. То есть атом светится в видимой области и даже эффект свечения можно объяснить при помощи модели Томпсона, но увы, тут возникла иная проблема. Даже если допустить, что атом водорода светится, то по этой модели он светится лишь с 1 частотой, когда как в реальности он испускает свет с 4 частотами. Так было доказано, что модель Томпсонов не верна и было необходимо создать новые модели.
Следующей моделью является модель Эрнеста Резерфорда 1908—1910 годов, который облучая металлические пластины тонкой золотой фольги радиоактивными излучениями, или точнее особыми альфа-частицами. При этом, если убрать пластинку на круговом экране (люминофоре, который светился), возникала точка, когда же ставилась пластина, то эта точка рассеивалась образуя пятно, но кроме того, часть этих лучей отражалась более чем на 90 градусов (прямой угол). И если предположить, что атом состоит так как предполагались Томпсоны, то из-за такого просто огромного «размазанного» положительного заряда на размер атома, отклонение не должно было превышать сотые доли градуса, а здесь было отклонение почти на 180 градусов.
Тогда Резерфорд и предположил, что для удовлетворения результатам эксперимента, нужно предположить, что положительный заряд сильно сконцентрировать в малой области, а всё оставшееся пространство практически пустует, поэтому частицы лишь немного рассеивались под действием электрического поля или же наталкивались на электроны, которые просто вращались вокруг атомного ядра. Именно так Резерфорд впервые и создал планетарную модель атома, по которой внутри имеется единое ядро, а вокруг него вращаются уже электроны по своим орбитам. Правда следовало ещё многое доказать, к примеру, почему электроны не падали атом, тратя свою энергию на вращение, излучая при этом энергию?
Но и на этот вопрос нашёлся ответ, благодаря коллеге Резерфорда – Нильсу Бору, который и создал модель атома водорода Бора, по его модели принимались некоторые постулаты. А именно утверждения того, что электрон не излучает энергию находясь на стационарных орбитах и могут выделять энергию в виде электромагнитного излучения (фотонов или частиц света) лишь при переходе из одной орбиты на другую, причём строго с той энергией, какой равняется разность энергии на этих двух орбитах. Из этого уже вытекало утверждение о квантовании энергии, то есть об оперировании с энергией, частицами, другими их параметрами только в виде порций. То есть не может быть плавного перехода, электрон либо он здесь есть, либо его здесь нет, либо он выделил определённое количество энергии, либо не выделил. Эта идея также поддерживалась ещё Максом Планком при изучении «совершенно чёрного тела», темы которая объясняла бы свечение при нагревании объектов.

Рис. 2.4. Эрнест Резерфорд

Рис. 2.5. Нильс Бор
Так при нагревании объектов часть энергии от столкновения атомов перетекает к ядру, а после передачи её электрону и переходу его на другой энергетический уровень, а затем обратно, наблюдается выделение фотона с определённой длиной волны, поэтому при нагревании тел они излучают свет. А уже при попадании на атом фотона внешнего, также наблюдается выход через переход электрона, но уже с более большой длиной волны и соответственно, меньшей частотой, благодаря чему и наблюдается такое явление как поглощение и отражение света. Что же касается прохода альфа-частиц при бомбардировке Резерфордом золотой фольги, то именно ядро с большим потенциалом и было причиной наличия таких результатов, как и тот факт, что практически на 99,9% атом пустой и на эти же 99,9% масса атома сосредоточена в его ядре. Таким образом модель Резерфорда смогла объяснить не только результаты того самого эксперимента Резерфорда, но и многие другие явления, что и подтверждает верность этой модели.
Также уместно указать, что электроны располагаются не только по круговым орбитам, но и по собственным отдельно определённым путям, формы которых напоминают «8» на разных осях. Это позволяет расположить гораздо большее число электронов к примеру, для таких больших атомов как уран, с порядковым номером 92, нептуний-93, кюрий-96, калифорний-98 и многие другие. Эти пути приведены из отдельной теории орбиталей, которая также доказывает явление квантования в мире элементарных частиц, откуда можно сделать вывод, что электроны не двигаются, впрочем, как и все микрообъекты, они появляются-пропадают, появляются-пропадают, такова их природа существования.
И всё это образует полную структуру атома. Эта структура образует так называемую «квантовую лестницу», которая отчетливо проявляется при определении размеров всех частиц. Сам атом имеет диаметр порядка 10—8 см, конечно он рознится у каждого атома, но средний размер равен именно этому показателю. В центре атома имеется собственное ядро с радиусом порядка 10—12 см. Вокруг ядра вращаются электроны с диаметром меньше 10—17 см, но это точечная частица для экспериментаторов, поскольку точный размер электрона на данный момент сложен в рассмотрении и даже при рассмотрении с таким показателем как 10—17 см потерей в точности не будет наблюдаться. Если только не учитывать эксперименты с повышенной точностью, направленные на исследование более высоких разрешений.

Рис. 2.6. Квантовая лестница
Ядро же само является составным и состоит из частиц именуемые нуклонами, при дальнейшим приближении можно убедиться, что внутри ядра имеется 2 типа нуклонов: протоны и нейтроны. Каждый из них по собственному размеру приблизительно составляет 10—13 см. А при дальнейшем приближении можно наблюдать уже более малые частицы – кварки. Кварки сами по себе являются уже точечными частицами и имеют размер также меньший 10—17, как и электроны.
Если говорить о дальнейшем увеличении и прохождении ещё дальше в глубины материи, то что там будет и как это выглядит, сегодня неизвестно. Но факт в том, что это сделать даже сегодня довольно трудно.
И сегодня квантовый мир предстаёт именно в этом виде. Производятся удивительные операции с этими и многими другими частицами, образуются многие другие частицы. Само же изучение квантового мира является очень даже важным, поскольку уже сегодня изучение в этой области привело к целому ряду открытий, ярким примером которого является создание технологий АЭС, создание ускорителей элементарных частиц, исследования в области проведения термоядерных реакций, широко известных под названием «создание искусственного Солнца» и многие другие исследования получили истоки именно в этой области. А также именно в этой области было зарождено исследование «Электрон», к которому и ведётся это повествование.
Открытие Конрадом Рентгеном особых лучшей испускаемых катодной трубкой, которые в дальнейшем получили имя самого Рентгена, вызвало большой фурор. Многие учёные начали активные исследования, но не успел мир оправится от этого удивления, как внезапно были открыты удивительные материалы, которые испускали эти удивительные лучи. Анри Беккерель, являющийся одним из знаменитых учёных, исследовавших флюоресценцию, решил доказать факт связи этого явления с радиоактивным источником – урановой солью. Именно тогда Беккерель в 1896 году оставил на фотопластинке материал без освещения по случайности и заметил, что на фотопластинке имелись потемнения, доказывающие, что соль сама по себе испускает удивительные лучи. Многие учёные исследовали это явление, пока не было доказано, что эти излучения – результат радиоактивного распада атомных ядер.
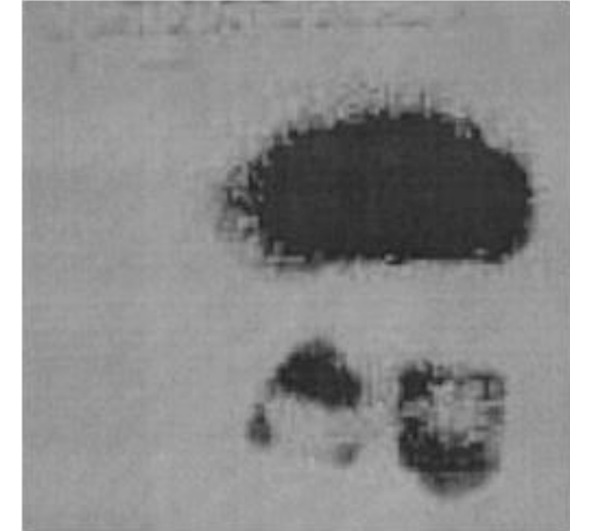
Рис. 2.7 Фотография, сделанная Беккерелем
Именно по этой причине 1896 год считается годом начала исследования в области атомного ядра. Также было известно, что если направить сфокусированное излучение из радиоактивного источника (урановую соль) поместив её в свинцовую камеру с единственной щелью, а затем на пути этого изучения расположить магниты, то это излучение будет разделено на 3 типа. При этом поток излучения, которое было направлено направо имеет отрицательный заряд, поток, который был повёрнут налево же имеет положительный заряд, что легко доказывается из закона Лоренца. А третье излучение, которое не было отклонено не имеет заряда.
Таким образом положительное излучение получило название альфа-частиц, а после измерения масс этих частиц исходя из формулы силы Лоренца при изменении индукции магнитного поля (принцип действия масс-спектрометра) можно было убедится, что это ядра атома гелия. Отрицательные частицы, которые были названы бета-частицами, при таком же анализе оказались просто быстрыми электронами, а лучи, которые не были отклонены, получили название гамма-излучения.
После того, как первоначально был проведён анализ структуры радиоактивного излучения, можно убедится, что само излучение состоит из 2 типов частиц и 1 типа волн, а именно гамма-излучения, благодаря чему уже можно привести общее определение радиоактивности:
Радиоактивность – самопроизвольное испускание атомными ядрами различных частиц и излучений.
Говоря уже более подробно о датах определения и исследования радиоактивности необходимо указать, что к 1900 году все типы радиоактивности уже были исследованы, хотя само атомное ядро было открыто Эрнестом Резерфордом лишь в 1911 году. Первое излучение – альфа-излучение, которое как уже было определено состоит из ядер гелия было открыто в 1898 году тем же Эрнестом Резерфордом и стало известным как альфа-распад. Также бета-распад или вылет электронов был открыт тем же Резерфордом в том же 1898 году. Но вот гамма-излучение было определено и исследовано лишь в 1900 году Полем Ульришем Виллардом.
Эти исследования и доказали, что потемнения пластин, наблюдаемые Беккерелем вызывалось именно радиоактивным излучением. Следовательно, теперь можно прийти к понятию радиоактивного распада:
Радиоактивный распад – спонтанный процесс, характерный для явлений микромира на квантовом уровне. При этом результат радиоактивного распада невозможно предсказать точно, лишь определить вероятность. Такая природа явлений не является несовершенством приборов, а является представлением уже самих процессов квантового мира.
Из этого утверждения можно сделать вывод, что должен быть некий общепринятый закон объясняющий это явление. Вывод закона радиоактивного распада представляется следующий образом:
Пусть в некий момент времени t имеется N (t) одинаковых радиоактивных ядер или нестабильных частиц и вероятность распада отдельного ядра (частицы) в единицу времени равняется λ.
В таком случае, за промежуток времени dt число радиоактивных ядер (частиц) уменьшится на dN, откуда вытекает следующее выражение (2.7).

Если же вывести из этого соотношения изменение по времени, то получается (2.8).

В (2.8) понятие τ, определяется в (2.9) и является средним временем жизни ядра (до распада), что довольно удобно к использованию, а N (0) в этом случае – это число ядер в начальный момент времени.

Также можно представить ещё один более упрощённый вид (2.8) в (2.10).

Где время с половинным индексом является периодом полураспада и вычисляется по (2.11) и равняется отдельному значению для каждого радиоактивного ядра.

Если же необходимо определить среднее число распадов (для распада с малой скоростью) вычисляется по (2.12).

При преобразовании данной закономерности образуется кривая радиоактивного распада (Рис. 2.8).
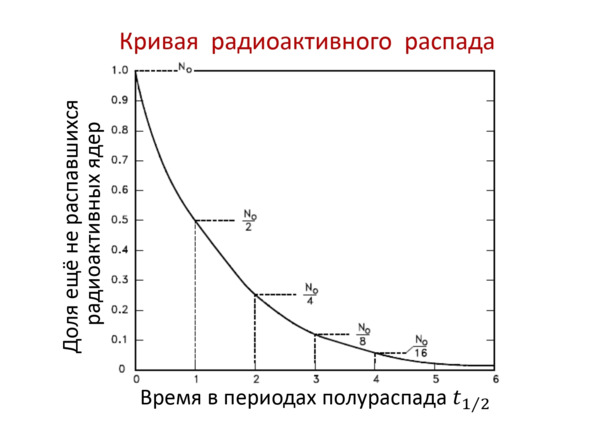
Рис. 2.8. Кривая радиоактивного распада
Из графика может увидеть, что закономерность экспоненциальная и при этом уменьшается каждый раз на половину периода с последующим уменьшением.
В качестве экспериментального анализа этого явления, можно показать следующее. Было проведено 100 измерений за одинаковый промежуток времени и при этом измерено число распадов. В результате был получен график на (Рис. 2.9), где среднее число распадов равное 77,47 совпало со значением в (2.12), что является ярким доказательством верности общей закономерности.

Рис. 2.9. Результат эксперимента
Общий вид распределения этой статистике представляется уже по иному закону. То есть вероятность Pn за время t на испытание n числа распадов выдаётся распределением Пуассона (2.13).
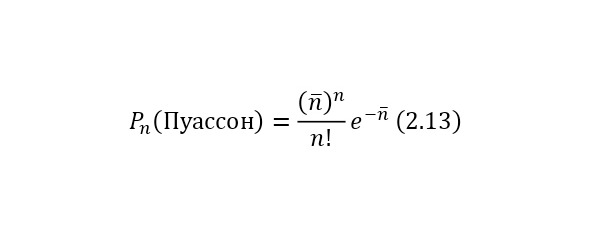
Этот вывод уже присущ теории вероятности, и если полагаться на него, то также для случая, когда (n>> 1) используются уже распределения Гаусса (2.14).

Если же выражать эти две закономерности на графиках, можно получить почти совпадающие картины с увеличением среднего числа распадов. К примеру если среднее число распадов равно 2, то имеет место некоторая разница в результатах по распределению Пуассона и Гаусса, но когда это число, к примеру, достигает 7 и больших значений, эта разность становится всё менее значительной, что показано на (Рис 2.10).

Рис. 2.10. График вероятности распада по распределениям Пуассона и Гаусса для среднего числа распада равным 2 и 7
После того как с вероятностью на нулевой скорости было решено, можно обратить внимание на случаи, когда в дело вступают эффекты теории относительности. В микромире, где размеры изучаемых объектов практически невидимы, к примеру, для атомов с их размерами в 10—8 см, для атомных ядер с их 10-12-10-13 см и для прочих частиц с 10-13-10-17 см, скорости часто бывают сопоставимы, близки или даже равны скорости света. Благодаря этому в микромире отчётливо проявляются все особенности и эффекты теории относительности.
По этой причине, важно подробнее рассмотреть соотношения и основные уравнения из теории относительности.
Одним из важнейших элементов в теории относительности является Лоренц-фактор (2.15), который участвует почти во всех формулах теории относительности, который также можно вывести из формулы кинетической энергии (2.16).


Из этих соотношений можно сделать вывод, что полная энергия, которая является суммой кинетической энергии и энергии покоя частицы определяется по (2.17).

Наличие этого равенства приводит к тому, что решается проблема отсутствия формулы для вычисления энергии частиц, не имеющих масс (пример, фотон или глюон). А уже из (2.16) также можно вывести более упрощённую запись для кинетической энергии (2.18). В случае же применения (2.15) для формулы импульса (2.19), получается также упрощённый вид.

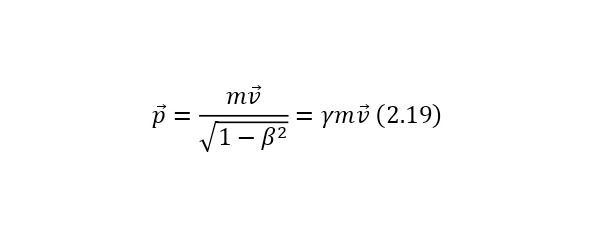
Скорость же частицы выводимая из формул полной энергии (2.17) выглядит следующим образом (2.20).

Важным элементом также в вычислениях, также это полная энергия безмассовых частиц, является формула (2.21), где выводы которой приводятся также из соотношения полной энергии (2.17).
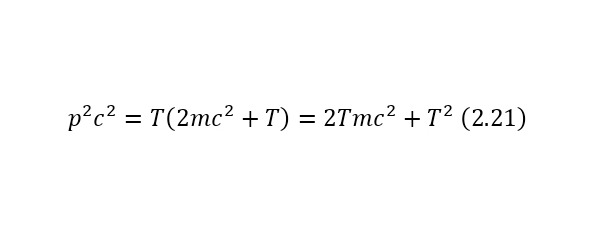
Понятие инварианта также играет роль в этом определении. Инвариант – это неизменная величина, вне зависимости от системы отчёта, с которого ведётся наблюдение. В данном случае, инвариантом является квадрат массы или (2.22).

И при этом не имеет значение, это одна частица или система частиц, поэтому полная энергия Е также относится к частице или системе частиц, также и импульс частицы относится как к частице или же системе частиц.
Одним из самых важных моментов в изучении физики атомного ядра и элементарных частиц, является знакомство с системой единиц, которой легче всего проводить вычисления – это Гауссовая система единиц вместе с некоторыми внесистемными величинами.
Говоря о единицах энергии, то благодаря малому количеству энергий, удобно использовать единицу электронвольт (эВ), что равняется 1,6*10—19 Дж или 1,6*10—12 эрг. Эта величина представляет собой энергию, которую приобретает электрон, проходя разность потенциалов в 1 Вольт. Также уместны значения в 1 кэВ (килоэлектронвольт) или 103 эВ, 1 МэВ или 106 эВ, 1 ГэВ или 109 эВ и 1 ТэВ или 1012 эВ, что активно применяются в физике элементарных частиц и атомного ядра.
Единицей длины или расстояний принято использовать значение в 1 Ферми (Фм) в честь знаменитого учёного Энрико Ферми, что также совпадает со значением в 1 фемтометр (фм), где 1 Фм равняется 10—13 см. Что же касается массы, то она выражается в энергетических единицах mc2, к примеру, масса электрона, которая в обычной системе единиц СИ составляет 9,11*10—28 грамм, то в энергетических единицах составляет 0,511 МэВ. А масса протона, которая составляет 1,6727*10—24 грамма, в энергетическом эквиваленте составит 938,27 МэВ.
Специальная и общая теория относительности имеют множество эффектов, то большего внимания заслуживают 3 из них. Первый из них – это замедление времени для релятивисткой частицы, второй – эффект сокращения расстояния в направлении движения релятивисткой частицы и третий эффект, который между прочим, выходит из общей теории относительности – замедление времени в гравитационном поле, также известный как гравитационное красное смещение излучения. Для лучшего понятия этих эффектов, рассмотрим 3 случая.