Этиология, патогенез
Инсульт определяется как внезапный неврологический дефицит, возникающий вследствие ишемии или геморрагии в центральной нервной системе (ЦНС). Инсульт, или нарушение мозгового кровообращения, возникает в результате нарушения кровоснабжения определенных участков мозга, приводящего к поражению мозговой ткани на этом участке. Масса мозга человека всего лишь около 1,5 кг, что составляет приблизительно 2 % массы тела, и все же 15 % сердечного выброса направляются непосредственно к мозгу, который поглощает 20 % объема кислорода, используемого организмом.
Мозг – уникальный жизненно важный орган, поэтому природа позаботилась о его защите. Кровоснабжение мозга в норме является автономным, во многом не зависящим от уровня общего кровообращения, так как имеет собственную систему регуляции. Однако эта независимость сохраняется лишь до тех пор, пока систолическое (верхнее) артериальное давление не превышает 180 мм рт. ст. Если же оно переходит эту грань, то мозговой кровоток начинает пассивно следовать за увеличением общего артериального давления. Функционируя в нормальных условиях, мозг перераспределяет потоки крови между отдельными своими зонами соответственно их энергетическим затратам. Значительное повышение артериального давления может вызвать срыв саморегуляции мозгового кровообращения и нарушение функций мозга.
Главные виновники возникновения инсульта – сердечно-сосудистые заболевания, прежде всего артериальная гипертония и атеросклероз. Артериальная гипертония (АГ).
Артериальная гипертензия – состояние, кардинальным признаком которого является повышение АД до уровня 140 и (или) 90 мм рт. ст. и выше, причем повышение данного параметра должно быть зафиксировано не менее 2–3 раз и не быть связанным с сиюминутной ситуацией (реакцией на белый халат).
Все артериальные гипертензии делятся на:
1) гипертоническую болезнь, или эссенциальную гипертонию (80 %). При этом повышение артериального давления – основной, иногда даже единственный симптом заболевания;
2) вторичную, или симптоматическую, гипертонию (20 %).
Гипертоническая болезнь (ГБ) относится к числу наиболее распространенных заболеваний сердечно-сосудистой системы. В России гипертоническая болезнь выявляется у 14–23 % взрослого населения.
Гипертоническая болезнь – один из факторов риска развития ишемической болезни сердца (ИБС), главная причина цереброваскулярных заболеваний, в том числе мозгового инсульта. В популяции трудоспособного возраста сосудистые заболевания головного мозга выявлены у 20 % лиц, из которых 65 % страдали артериальной гипертензией (АГ), а среди больных с нарушением мозгового кровообращения более 60 % имели мягкую АГ.
Гипертоническая болезнь возникает чаще всего в высокоразвитых странах и у людей с повышенной психоэмоциональной нагрузкой, что является прямым доказательством ведущей роли ЦНС в развитии гипертонической болезни. Длительное психоэмоциональное напряжение и отрицательные эмоции – основной предрасполагающий фактор гипертонической болезни.
Факторы риска эссенциальной гипертонии (ЭГ).
1. Наследственность. Наиболее доказанный фактор риска. Особое значение имеет ЭГ у матерей больных. Считается, что в 30 % случаев колебания АД генетически детерминированы, а на 50 % обусловлены факторами внешней среды. О полигенности этого заболевания свидетельствует тот факт, что наследование большинства случаев АГ не подчиняется классическим менделеевским законам. Предполагается, что за развитие АГ ответственны гены РААС (гены АПФ, ангиотензиногена, рецептора к А-II), аполипопротеинов, аддуцина, эндотелиальной NO-синтетазы. Ряд форм артериальной гипертензии развивается в результате мутаций одного гена, в связи с чем эти случаи описываются как моногенные разновидности гипертензии, а их наследование подчиняется менделевским законам (синдром Лиддла, синдром GRA, синдром Г ордорна, синдром кажущегося избытка минералокортикоидов). Ю. В. Постновым на линии крыс SHR доказано, что геномной детерминантой спонтанной гипертензии является не изменение гена или группы генов, а количественные изменения и перемещения повторяющихся последовательностей генома – элементов, не несущих конкретной генетической информации. Увеличение числа копий (амплификация) повторяющихся последовательностей или реорганизация кластеров этих последовательностей рассматриваются в качестве физической основы последующего нарушения функции генов, вовлеченных в область подобной перестройки.
2. Масса тела. При избыточной массе тела риск увеличивается в 2–6 раз (индекс Кетле более 25, окружность талии более 85 см у женщин и более 98 см у мужчин).
3. Метаболический синдром (синдром Х) – ожирение андроидного типа, резистентность к инсулину, гиперинсулинемия, нарушения липидного обмена (снижение уровня ЛПВП положительно коррелирует с подъемом артериального давления).
4. Потребление алкоголя. Систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД) у лиц, ежедневно потребляющих алкоголь, соответственно на 6,6 и 4,7 мм рт. ст. выше, чем у лиц, употребляющих алкоголь 1 раз в неделю.
5. Потребление соли. Имеется связь между развитием АГ и потреблением хлорида натрия, но между высотой подъема АД и количеством употребления соли наблюдается лишь слабая корреляция.
6. Физическая активность. У лиц, ведущих сидячий образ жизни, вероятность развития АГ на 20–50 % выше, чем у физически активных людей.
7. Психосоциальный стресс. Длительный хронический стресс ведет к развития ЭГ. Имеют значение и личностные особенности больного:
– высокая степень ответственности, высокие требования к себе и окружающим;
– высокая эмоциональность;
– амбивалентная зависимость больного от значимых фигур в его окружении (в сочетании с гипертрофированной потребностью во внимании, любви, страхом потерять это внимание и любовь);
– фрустрированная потребность в доминировании над значимыми фигурами в своем окружении;
– повышенная тенденция реагировать «агрессией» на фрустрацию;
– равносильная тенденция подавлять агрессивные эмоции (в том числе связанные с фрустрацией).
Основные и дополнительные факторы риска развития сердечно-сосудистых осложнений:
1) основные факторы риска:
– мужской пол и менопауза у женщин;
– курение;
– холестерин более 6,5 ммоль/л;
– семейный анамнез ранних сердечно-сосудистых заболеваний (<65 лет у мужчин и <55 лет у женщин);
2) дополнительные факторы риска;
– снижение липопротеидов высокой плотности (ЛПВП);
– повышение липопротеидов низкой плотности (ЛПНП);
– микроальбуминурия при диабете;
– нарушение толерантности к глюкозе;
– ожирение;
– сидячий образ жизни;
– повышение уровня фибриногена;
– эндогенный тканевой активатор плазминогена;
– ингибитор активатора плазминогена тип 1;
– липопротеин (а);
– фактор VII;
– гомоцистеин;
– D-димер;
– С-реактивный белок;
– дефицит эстрогенов;
– Chlamidia pneumoniae;
– Определенное социально-экономическое положение;
– этническая принадлежность;
– географический регион.
Гемодинамические факторы, определяющие уровень АД:
1) сердечный выброс или минутный объем сердца (МОС);
2) проходимость резистивных сосудов.
Сосуды резистивного типа по классификации Фолкова (1967 г.) и Ткаченко (1994 г.) – это артериолы и венулы, расположенные в пре– и посткапилярных областях сосудистого русла. Сопротивление осуществляется:
1) морфологически – толстая стенка по сравнению с просветом;
2) физиологически – способностью мышечной оболочки находиться в постоянном тонусе. Тонус этих сосудов обусловлен двумя факторами:
а) структурными особенностями – жесткая «сосудистая сумка из коллагена»;
б) миогенным фактором – та часть сокращения, которая возникает в ответ на растяжение кровью и обусловлена изменениями обмена в мышечной ткани, в частности обмена катионов;
3) упругим напряжением стенок аорты и ее крупных ветвей, создающим общее эластическое сопротивление (Ео);
4) вязкостью крови.
Вязкость – способность оказывать сопротивление течению жидкости при перемещениях одних частиц относительно других за счет внутреннего трения. Вязкость крови увеличивается при увеличении крупномолекулярных белков (фибриногена, липопротеинов), уменьшении суспензионных свойств крови). Кровь – неньютоновская жидкость: При понижении артериального давления вязкость крови увеличивается, при повышении АД вязкость уменьшается.
Основное влияние на уровень АД оказывают МОС и проходимость резистивных сосудов, поскольку у здоровых людей вязкость крови является постоянной величиной (при сужении резистивных сосудов вязкость может возрастать, дополнительно увеличивая проходимость резистивных сосудов).
Согласно синтетической концепции регуляции АД (А. Гайтон) биокибернетические механизмы сосредоточены в двух основных системах.
1. Система кратковременного действия, или адаптационная (пропорциональная) контрольная система представлена 2-мя основными регуляторными контурами или петлями биологической обратной связи:
– барорецепторы крупных артерий – центры головного мозга (ГМ) – симпатические нервы – резистивные сосуды, емкостные сосуды, сердце – повышение АД; о почечный (плазменный) эндокринный контур (юкстагломерулярный аппарат ЮГА) – ангиотензин II – резистивные сосуды – повышение АД.
2. Система длительного действия, или интегральная контрольная система.
Барорецепторный рефлекс
Барорецепторы дуги аорты и синокаротидной зоны + изменение АД – залповая афферентная импульсация через IX–X пару черепно-мозговых нервов (ЧМН) – 3 интегральных участка ЦНС:
1) дорзомедиальная медулла, nuclei tractus solitarii (NTS) – депрессорный эффект (опосредованный L-глутаматом, субстанцией P);
2) каудальная вентролатеральная медулла – снижение периферической симпатической активности, снижение проходимости резистивных сосудов – депрессорный эффект (опосредован норадреналином);
3) ростральная вентролатеральная медулла – повышение АД.
Барорефлексы достигают максимального эффекта через 10–30 с после начала воздействия и отвечают за колебание АД от 100 до 125 мм рт. ст.
Почечный (плазменный) эндокринный механизм К эндокринным аппаратам почек относят:
– юкстагломерулярный аппарат (ЮГ А), выделяет ренин и эритропоэтин; о интерстициальные клетки (ИК) мозгового вещества и нефроциты собирательных трубок (НСТ), вырабатывают простагландины; о калликреин-кининовая система (ККС); о клетки APUD-системы, содержащие серотонин.
ЮГА
В этом аппарате выделяют 4 компонента:
1) гранулированные эпителиоидные клетки в стенке афферентной артериолы (юкстагломерулярные клетки);
2) клетки плотного пятна;
3) клетки Гурмагтига (lacis-клетки);
4) мезангиальные клетки клубочка.
ЮГА-клетки вырабатывают ренин – катализатор начального этапа образования ангиотензина. В ЮГА-клетках ренин сосредоточен в специальных секреторных гранулах. Помимо этих гранул, в клетках имеются и неспецифические, например гранулы липофусцина.
Роль своеобразного рецептора играет плотное пятно, реагирующее на качественный состав содержимого дистального канальца. Плотное пятно в свою очередь взаимодействует с эпителиоидными клетками через клетки Гурмагтига, что имеет морфологические доказательства. Клетки Гурмагтига, негранулированные гладкомышечные клетки и мезангиальные клетки при гипертрофии ЮГА могут участвовать в выработке ренина, превращаясь в ЮГА-клетки.
ИК мозгового вещества и клетки собирательных трубочек
Ось ИК мозгового вещества ориентирована перпендикулярно к длиннику сосочка пирамиды, они расположены параллельно друг другу и лежат между собирательными трубочками, сосудами и тонкими сегментами петель Генле. ИК имеют длинные цитоплазматические отростки, позволяющие им контактировать с сосудами, канальцевым аппаратом почки и друг с другом. Клетки содержат липидные капли, причем концентрация гранул в ИК и самих ИК в мозговом веществе почки возрастает по направлению к вершине сосочка.
Функция ИК заключается в синтезе и выделении почечных простагландинов. Нефроциты собирательных трубочек также участвуют в синтезе почечных простагландинов, но меньше, чем ИК.
Калликреин-кининовая система
Представлена в почках нефроцитами дистальных канальцев. Калликреин, выделяясь в просвет канальцев, взаимодействует с кининогенами; образующиеся кинины могут достигать мозгового вещества почки и вызывают высвобождение простагландинов из ИК и НСТ.
Взаимодействие эндокринных аппаратов почек
Клеточная гетерогенность ЮГА обеспечивает ауторегуляцию его функций: клетки плотного пятна улавливают изменения состава мочи (снижение концентрации хлорида натрия в моче, например, ведет к повышению активности ренина в плазме); мезангиальные клетки, обладающие рецепторами к ангиотензину II, улавливают изменения состава плазмы крови, а эпителиоидные и гладкомышечные клетки ЮГА, имеющие П-рецепторы, – изменения уровня артериального давления. Синтез ренина находится под контролем простагландинов, синтез простагландинов – под контролем ККС.
Почечный механизм проявляет активность в узком диапазоне – от 100 до 65 мм рт. ст. В основном включается при острой гипотензии.
ЮГА выделяет ренин, который в норме на 80 % находится в неактивном состоянии (проренин). Ренин является протеолитическим ферментом – аспартилпротеазой. Допускается, что активизация проренина осуществляется почечным калликреином. Поврежденные почки, в отличие от здоровых, секретируют преимущественно активный ренин, но повреждение не влияет на выделение проренина.
Ренин взаимодействует с плазменным белком П2-глобулином (тетрадекапептидом), называемым субстратом ренина или ангиотензиногеном. В результате образуется ангиотензин I (декапептид).
Ангиотензин I под влиянием ангиотензинконвертирующего фермента (АКФ) превращается в ангиотензин II. АКФ является дипептидилкарбоксипептидазой, отщепляющей с С-концевого участка молекулы ангиотензина I 2 аминокислотных остатка. Дигидропептидилкарбоксипептидаза выполняет 2 функции:
1) функцию АКФ;
2) функцию кининазы II – инактивацию брадикинина в результате отщепления с С-конца двух аминокислотных остатков.
Кроме того, АКФ участвует в метаболизме атриопептина, субстанции Р, энкефалинов, t– цепи инсулина, t-липотропина, рилизинг фактора лютенизирующего гормона.
АПФ (дипептидилкарбоксипептидаза) идентична кининазе II, вызывающей разрушение брадикинина.
В соматической форме АКФ имеются 2 активных центра, гомологичных домена: в N– участке, C-участке молекулы фермента. Каталитическая активность и химическая структура N и C доменов неодинаковы. C-домен катализирует расщепление ангиотензина I и брадикинина, тогда как N-домен расщепляет преимущественно рилизинг-гормон лютеинизирующего гормона.
Ингибиторы АКФ различаются по силе и избирательности связывания с активными центрами в молекуле соматической формы АКФ: каптоприл имеет сродство с N-доменом, лизиноприл – с C-доменом, трандолаприл – с обоими.
В микрососудах АПФ располагается на мембранах клеток. Этот фермент находится в адвентиции крупных сосудов в связи с vasa vasorum. Циркулирующие молекулы АПФ попадают в кровь, отделяясь от тканевых гликопротеидов. Важнейшая роль легких в превращении А! в АП обусловлена богатой их васкуляризацией и тем, что вне легких АП не подвергается инактивации.
Физиологические эффекты А-II, опосредованные АТ1 и АТ2 рецепторами – ангиотензиновыми рецепторами первого и второго типов

Все известные физиологические сердечно-сосудистые и нейроэндокринные эффекты. А II опосредованы АТ1-рецепторами. Все они способствуют повышению АД, развитиюгипертрофии левого желудочка, утолщению стенок артериол, что способствует уменьшению их просвета. Эффекты АН, которые опосредуются АТ2 рецепторами, – вазодилятация и торможение пролиферации клеток, в том числе кардиомиоцитов, гладкомышечных клеток. Таким образом, через АТ2-рецепторы АТП частично ослабляет свои эффекты.
АТ1-рецепторы на мембранах гепатоцитов и клетках ЮГА почек опосредуют механизмы обратной отрицательной связи в ренин-ангиотензиновой системе. Поэтому в условиях блокады АТ1-рецепторов в результате нарушения этих механизмов обратной отрицательной связи увеличивается синтез ангиотензиногена печенью и секреция ренина клетками ЮГА. То есть при блокаде АТ1-рецепторов происходит реактивная активация ренин-ангиотензиновой системы, которая проявляется повышением уровня ангиотензиногена, ренина, АТ-I и АТ-II. Повышение образования АТ-II в условиях блокады АТ1-рецепторов приводит к тому, что преобладают эффекты стимуляции АТ:-рецепторов.
Третий механизм антигипертензивного действия блокаторов АТ1-рецепторов объясняется повышением образования ангиотензина (I-7), обладающего вазодилятирующими свойствами, – он образуется из А-I под действием нейтральной эндопептидазы или из А-II под действием пролиловой эндопептидазы. АТ (I-7) обладает, пaомимо вазодилятирующего, натрийуретическим свойствами, которые опосредуются простагландинами, простацилинами, кининами, эндотелиальным релаксирующим фактором. Эти эффекты обусловлены воздействием на АТх.
Влияние АТ-II на функцию и структуру клетки

Белки РААС и их генетические детерминанты
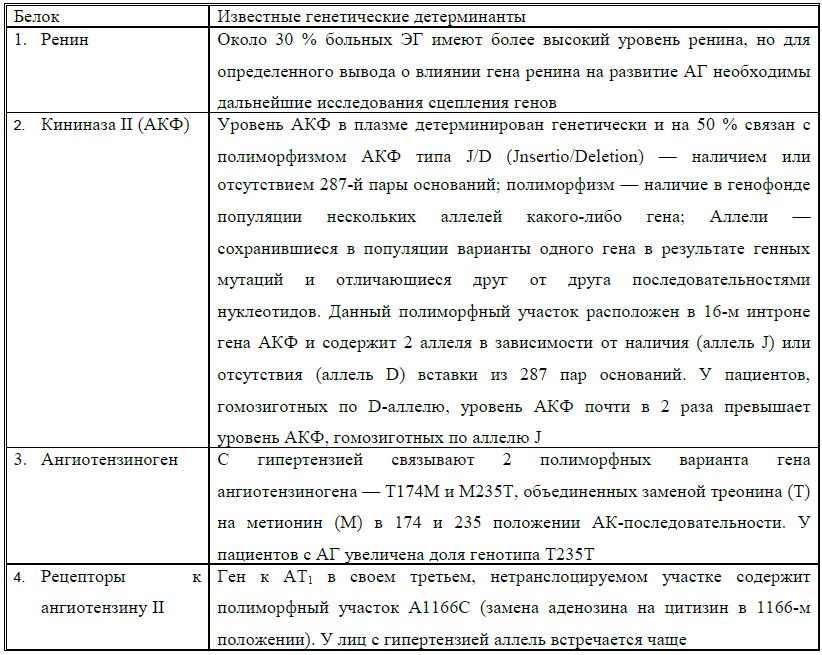
Интегральная система регуляции АД включает:
1) цепь почки – кора надпочечников (альдостерон) – консервация ионов натрия – жидкая среда организма;
2) депрессорные механизмы, сосредоточенные в мозговом слое почек и стенках резистивных сосудов.
Помимо циркулирующей в крови (эндокринной системы), имеются местные системы ренин – AII, оказывающие аутокринные («на себя») и паракринные («на соседние клетки») влияния, изменяющие локальные тканевые функции.
Между почечной (эндокринной) и местными (аутокринной и паракринной) системами нет четкой связи. Локальные системы способны оказывать длительное воздействие на резистивные сосуды, регулируя их проходимость. Тканевые системы в большей степени участвуют в осуществлении противогипертензивного эффекта. Ингибиторы АПФ тормозят образование АП на месте и вызывают обратное развитие гипертрофии гладкомышечных клеток и поперечно-полосатой мускулатуры миокарда.
Воздействие А11 на баланс натрия и жидкой среды организма – важнейшая функция интегрирующей, длительно действующей системы регуляции. Усиление реабсорбции натрия обеспечивается двумя механизмами:
1) непосредственным воздействием А II на почечные канальцы;
2) опосредованным усилением секреции альдостерона клетками клубочкового слоя коры надпочечников.
Системы регуляции АД

Данные системы не антагонистичны в функциональном плане.
Выявлены значительные гетерогенность и разнонаправленность действия различных типов α– и β-АР. В пределах системы простагландинов имеются как вазоконстрикторные (простагландины ПГ-F2α, ТХ-А2), так и вазодилятаторные субстанции.
Эндотелиальные системы состоят из прессорных компонентов (эндотелинов) и депрессорных. При ЭГ взаимодействие прессорной и депрессорной систем рассогласовано. Вначале, при лабильной гипертензии, повышается активность как прессорных, так и депрессорных систем с преобладанием первых, далее активность и тех и других систем снижается – прессорных до нормы, а депрессорных ниже нормы (этим центрогенная теория объясняет феномен стабилизации гипертензии).
Механизм «давление – натрийгидроурез» в норме является депрессорным, в условиях патологии способствует стабилизации АГ.
Имеется связь между потреблением поваренной соли и артериальной гипертензией. Но между количеством потребляемой поваренной соли и высотой АД имеется лишь слабая корреляция.
У крыс линии SHR резко усилен солевой аппетит, что может быть подавлено блокадой ренин-ангиотензиновой системы. Можно предположить и вторичное увеличение потребления соли в условиях гипертензии и высокой активности А-II.
При высоком артериальном давлении увеличивается натрийурез и гидроурез (при повышении АД от 100 до 150 мм рт. ст. натрий-, гидроурез увеличивается в 3 раза). Этот механизм есть следствие изменения канальцевой реабсорбции в тубулярных сегментах почечной медуллы и сохраняется на изолированной почке. Решающую роль играет интерстициальное гидростатическое давление.
Механизм «давление – натрийгидроурез» при ЭГ
Нормальное функционирование этого механизма возможно лишь в том случае, если причины, вызывающие изменение АД, одновременно не повреждают базисных внутрипочечных механизмов. При нарушении этого условия для удаления с мочой равновеликого (у здоровых людей) количества натрия и воды требуется более высокое АД, следовательно, происходит становление гипертензии (переключение почек на более высокий уровень регуляции).
В результате переключения почек происходит задержка натрия и воды. Вначале имеется недостаточное расширение артериол при высоком МОС, но оно относительно. Позже (в эксперименте с форсированным введением жидкости – на второй неделе) АГ зависит от абсолютного повышения ОПС. Этот эффект опосредован эндогенным гликозидом – оаубаином, выделяемым в условиях гипергидратации нейронами гипоталамуса и ингибирующего Na+/К+ АТФазу у мембран гладко-мышечных клеток резистивных сосудов – накопление в миоплазме ионов кальция и более интенсивное сокращение мышечных клеток с сужением просвета артериол и прекапилляров.
Теории патогенеза ЭГ
Можно выделить 3 наиболее распространенные теории:
1) центрогенную;
2) мембранную;
3) «мозаичную».
Центрогенно-нервная теория патогенеза ЭГ
С точки зрения Г. Ф. Ланга, ЭГ есть следствие психического перенапряжения человека, воздействия на его психическую сферу эмоций отрицательного характера, психотравматизации.
В эксперименте повышение норадреналина было обнаружено лишь у части молодых людей с лабильной и пограничной артериальной гипертензией. У больных в возрасте 40–60 лет концентрация норадреналина не отклоняется от нормы. Таким образом, нет оснований полагать наличие прямой связи между тонусом симпатической системы и артериальным давлением.
Первопричины, пускающие в ход цепную реакцию патогенеза, со временем у большинства больных сходят на нет («мавр сделал свое дело»). АД по-прежнему поддерживается на высоком уровне, но за счет других самовоспроизводящихся механизмов.