Глава 1. Взрывчатые
Как только двери самолета закрылись и мы отъехали от зоны посадки аэропорта Хитроу, голос в динамиках объявил о начале предполетного инструктажа по безопасности.
– Добрый день, дамы и господа, мы приветствуем вас на борту нашего лайнера British Airlines, отправляющегося рейсом в Сан-Франциско. Перед отправлением просим вашего внимания. Наш экипаж в салоне расскажет о том, что важно знать о безопасности на борту нашего воздушного судна.
Меня всегда смущает такое начало полета. Я убежден, что это фальшивка и предполетный инструктаж не имеет на самом деле никакого отношения к безопасности. Во-первых, в нем никогда не упоминаются десятки тысяч литров авиационного топлива на борту. Именно громадное количество энергии, заключенное в этой жидкости, позволяет нам летать; именно ее пламенная природа придает реактивным двигателям лайнера мощь и способность (в нашем случае) взять четыреста пассажиров в 250-тонном самолете, стоящем на полосе, и за несколько минут разогнать всё это до крейсерской скорости 900 км/ч и поднять на высоту 12 000 м. Потрясающая мощь этой жидкости питает самые безумные наши мечты. Она позволяет нам взмывать над облаками и достигать любой точки земного шара за несколько часов. Именно это вещество доставило первого космонавта планеты Юрия Гагарина на ракете в космос, и именно на нем работают ракеты последнего поколения компании SpaceX, которые выбрасывают спутники за пределы атмосферы. Это вещество называется керосин.
Керосин – прозрачная бесцветная жидкость, которая выглядит в точности как вода, и это сбивает с толку. Где же в ней вся эта скрытая энергия и мощь? Почему присутствие в этой жидкости громадного количества нерастраченной энергии не делает ее на вид, скажем, более густой и опасной? И почему ее никогда не упоминают во время предполетного инструктажа по безопасности?
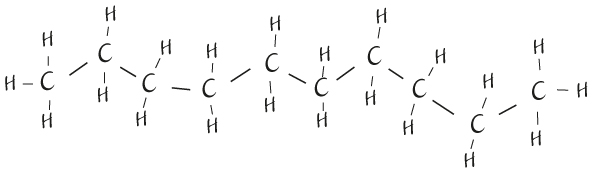
Структура углеводородной молекулы керосина
Если включить увеличение и взглянуть на керосин на атомном уровне, то можно увидеть, что по структуре его молекула напоминает спагетти. Основа, «хребет» каждой нити состоит из атомов углерода, соединенных в цепочку, где каждый атом связан со следующим. К каждому атому углерода прикреплены два атома водорода (только на концах молекулы – по три). В таком масштабе отличить керосин от воды нетрудно. Вода не имеет нитевидной структуры, это скорее хаотичное скопление маленьких V-образных молекул (один атом кислорода связан с двумя атомами водорода, H2O). В таком масштабе керосин больше похож на оливковое масло, которое тоже состоит из спутанных нитевидных молекул на основе углерода. Но если в керосине нити больше напоминают спагетти, то в оливковом масле они ветвистые и перекрученные.
Поскольку молекулы оливкового масла имеют более сложную форму, чем молекулы керосина, им сложнее протискиваться друг мимо друга, поэтому и течь этой жидкости труднее – иными словами, оливковое масло отличается большей вязкостью, чем керосин. То и другое – масло, и на атомном уровне они выглядят похоже, но из-за структурных различий оливковое масло густое, а керосин льется совсем как вода. Это различие определяет не только вязкость этих масел, но и степень их воспламеняемости.
Персидский врач и алхимик ар-Рази в IX в. написал об открытии керосина в своей «Книге тайн». Он заинтересовался естественными источниками в своем регионе, из которых текла не вода, а густая черная едкая жидкость. В те времена это похожее на гудрон вещество брали из источников и использовали на дорогах, преимущественно как покрытие. Чтобы проанализировать черное земляное масло, ар-Рази разработал особые химические процедуры, которые мы сегодня называем перегонкой. Он нагревал масло и собирал газы, которые из него выделялись. Затем он вновь охлаждал их, после чего они превращались обратно в жидкость. Первые жидкости, которые он выделил таким образом, были желтыми и маслянистыми, но после многократной перегонки они становились светлым, прозрачным и свободнотекущим веществом. Так ар-Рази открыл керосин.
Он не мог знать подлинных масштабов всего того, что открытая им жидкость принесет в этот мир, но он знал, что она горюча и дает бездымное пламя. Сегодня это открытие может показаться тривиальным, но во всех древних цивилизациях проблема внутреннего освещения стояла очень остро. Самой сложной технологией того времени были масляные лампы, но до ар-Рази горящее в лампе масло давало едва ли не больше сажи, чем света. Бездымные лампы стали бы поистине революционным новшеством – настолько, что его важность увековечена в истории про Аладдина из «Сказок тысячи и одной ночи». Герой находит волшебный предмет – масляную лампу. Стоит потереть ее, и оттуда появляется могущественный дух. Духи часто встречаются в мифах того времени и описываются как существа, состоящие из бездымного пламени; джинн из сказки обязан исполнять приказы владельца лампы. Это колоссальная сила. Значимость новой открытой жидкости и ее способность давать бездымное пламя не могли ускользнуть от внимания алхимика ар-Рази. Почему же персы не начали пользоваться ею? Ответ отчасти связан с той ролью, которую играли оливковые деревья в их экономике и культуре.
В IX в. персы заливали в лампы оливковое масло. Там прекрасно росли устойчивые к засухе оливковые деревья, плоды которых можно было использовать для производства масла. Примерно из двадцати оливок получалась чайная ложка масла, на которой типичная для того времени масляная лампа могла целый час гореть и давать свет. Так что, если средней семье требовалось пять часов света каждый вечер, она должна была тратить по сто оливок в день – или примерно тридцать шесть тысяч в год на каждую лампу. Чтобы производить достаточно масла для освещения империи, персам нужно было много земли и времени: оливковые деревья, как правило, первые двадцать лет не дают плодов. Кроме того, приходилось защищать свои земли от всякого, кто мог покуситься на этот ценный ресурс, – а значит, нужны организованные города, которые требовали еще больше оливок, чтобы масла хватало всем и для приготовления пищи, и для освещения домов. Чтобы содержать армию, надо было платить налоги, в Персии это зачастую означало передачу правительству определенной части полученного с урожая оливкового масла. Сами видите: оливковое масло играло центральную роль в обществе и культуре Персии, как и других ближневосточных цивилизаций, пока им не удавалось найти альтернативный источник энергии и налоговых поступлений. Эксперименты ар-Рази доказали, что он буквально под ногами, но там ему и суждено было оставаться еще тысячу лет.

Копия древней масляной лампы, использовавшейся во времена ар-Рази
Тем временем масляные лампы развивались. Конструкция IX в. кажется простой, но на самом деле она замечательно хитроумна. Представьте себе чашу с оливковым маслом. Если вы просто попытаетесь поджечь его, то обнаружите, что это сложно. Оливковое масло имеет очень высокую точку возгорания – температуру, при которой оно начинает спонтанно реагировать с кислородом воздуха и вспыхивает. Для оливкового масла она составляет 315°C. Вот почему готовить на нем так безопасно. Если случайно разлить его на кухне, оно не загорится. Кроме того, чтобы зажарить большинство продуктов, достаточно довести их до температуры около 200°C, что всё еще на сто градусов ниже точки возгорания оливкового масла. Поэтому, когда на нем готовишь, масло практически не горит.
Но при температуре 315°C ваш горшок с оливковым маслом ярко вспыхнет, испустив много-много света. Мало того что это невероятно опасно, так и пламя быстро потухнет; оно очень скоро поглотит всё топливо. Возможно, вы подумали: наверняка есть лучший способ жечь оливковое масло для освещения. Вы правы. Если взять кусок веревки и погрузить его в масло, оставив кончик торчать над поверхностью, а затем поджечь, на конце веревки возникнет яркий огонек, а весь горшок нагревать не придется. Горит при этом не веревка, а масло, выступающее на ней. Это весьма изобретательно, но дальше еще лучше. Если оставить веревку гореть, то окажется, что пламя не спускается по ней в масло – наоборот, масло взбирается по ней и вспыхивает только после того, как доберется до самого верха. Такая система способна поддерживать горение часами – ровно до тех пор, пока в чаше есть масло. Всё дело в процессе, который называется капиллярным поднятием и кажется чудесным: масло, оказывается, способно преодолевать тяготение и двигаться независимо. Но на самом деле это базовое свойство жидкостей, возможное потому, что они обладают так называемым поверхностным натяжением.
Способность течь придает жидкостям их структура: это промежуточное состояние между хаосом газов и молекулярной решеткой твердых тел. В газах молекулы обладают достаточной тепловой энергией, чтобы отрываться друг от друга и двигаться независимо. Это придает им динамичность – они расширяются, пока не займут весь свободный объем, – но в них нет почти никакой структуры. В твердых телах сила притяжения между атомами и молекулами намного превышает их тепловую энергию, заставляя их держаться вместе. Поэтому у твердых тел жесткая структура, но малая автономность молекул: когда вы берете со стола чашу, все ее атомы движутся вместе, как единый объект. Жидкости – промежуточное состояние между тем и другим. У атомов в них достаточно тепловой энергии, чтобы разорвать некоторые связи с соседями, но недостаточно, чтобы разорвать их все и стать газом. Они заперты в жидкости, но способны свободно двигаться в ее пределах. Это форма материи, в которой молекулы свободно плавают, образуя и разрывая связи друг с другом.
Среда, в которой существуют молекулы на поверхности жидкости, отличается от той, в которой существуют молекулы внутри ее. Молекулы на поверхности не окружены со всех сторон другими молекулами той же жидкости и поэтому образуют в среднем меньше связей, чем те, что находятся в толще жидкости. Неуравновешенность сил между поверхностью жидкости и ее толщей порождает напряжение – силу поверхностного натяжения. Она очень невелика, но достаточна, чтобы противодействовать силе тяготения для небольших объектов. Вот почему некоторые насекомые способны гулять по поверхности водоемов.

Водомерка на поверхности воды. © Alice Rosen
Посмотрите внимательно, как водомерка «ходит» по воде, и вы заметите, что та отталкивает ножки насекомого. Причина в том, что поверхностное натяжение между водой и ножками насекомого порождает силу отталкивания, которая противодействует тяготению. Некоторые виды взаимодействия жидкости и твердого тела имеют противоположный результат: они порождают силу молекулярного притяжения. Это относится, в частности, к воде и стеклу. Если взять в руку стакан с водой, можно увидеть, что ее край у границы со стеклом слегка приподнимается. Он называется мениском, и это тоже результат действия силы поверхностного натяжения.
Растения освоили этот фокус. Они втягивают воду наверх вопреки силе тяготения, из земли в свои тела, при помощи системы крохотных трубочек, которые проходят сквозь их корни, стебли и листья. Когда они становятся микроскопическими, отношение площади внутренней поверхности к объему жидкости увеличивается и описанный эффект усиливается. Потому-то производители продают тряпки для мытья окон из «микрофибры», в которой есть микроканалы, аналогичные микроканалам растений. Они всасывают воду, позволяя тряпке очищать стекло эффективнее. Мы можем вытирать пролитую жидкость с помощью кухонных салфеток благодаря тому же механизму. Всё это примеры капиллярного всасывания (капиллярного поднятия), того самого, что возникает под действием силы поверхностного натяжения и позволяет маслу взбираться вверх по веревке – точнее, по фитилю.
Без капиллярного поднятия свечи не могли бы гореть. Когда вы поджигаете фитилек, жар огня расплавляет вещество вокруг и создает лужицу расплавленного воска. Он поднимается по фитильку через микроканалы к пламени. Так он питает пламя новыми порциями жидкого воска, который и сгорает. Если подобрать для фитиля подходящий материал, пламя будет достаточно горячим, чтобы поддерживать существование лужицы жидкого воска и обеспечивать постоянный приток топлива. Эта обманчиво сложная система саморегулирующаяся и требует так мало внимания и вмешательства, что мы давно уже не воспринимаем свечи как техническое устройство, хотя, строго говоря, именно таковыми они и являются.
Тысячи лет по всему земному шару капиллярное поднятие было главным механизмом внутреннего освещения – и в свечах, и в масляных лампах. Без этих двух устройств мир по ночам погружался в темноту и мрак. Вполне ожидаемо, что лампы были популярны там, где в изобилии имеется какое-либо масло, а свечи – там, где проще было достать воск или животный жир. Однако, несмотря на хитрое устройство, у свечей и масляных ламп были свои недостатки: помимо их пожароопасности, еще и сажа, малая яркость пламени, запах и цена. Поэтому всегда находились люди, которые занимались поиском лучших, более дешевых и безопасных способов внутреннего освещения. Открытие Мухаммадом ар-Рази керосина в IX в. могло бы стать решением проблемы, если бы кто-нибудь до этого додумался.
Предполетный инструктаж по безопасности на борту авиалайнера был в разгаре, и теперь бортпроводники тоже игнорировали значение керосина. До сих пор его ни разу не упомянули, хотя в тот самый момент эту замечательную штуку впрыскивали в реактивные двигатели под крыльями лайнера, чтобы они вывели его на взлетную полосу. А бортпроводники говорили о том, что делать в случае «разгерметизации салона». Я, как англичанин, могу по достоинству оценить, мягко говоря, сдержанность этой фразы. Звучит не особенно впечатляюще, и кажется, что тут нет ничего страшного; на самом же деле, если во время крейсерского полета на большой высоте в обшивке салона внезапно появится дырка или трещина, из него будет быстро высосан воздух вместе со всеми, кто окажется в этот момент не пристегнут к креслу. После этого кислорода в воздухе останется недостаточно для нормального дыхания – отсюда маски, автоматически падающие с потолка. Самолет при этом должен немедленно начать крутой спуск на меньшие высоты, где кислорода в воздухе больше. И тогда каждый, кто доживет до этого момента, бесспорно, будет уже в безопасности.
Недостаток кислорода был серьезной проблемой и для древних масляных ламп. Их конструкция не обеспечивала приток к горящему фитилю количества кислорода, достаточного для полного сгорания топлива, и пламя лампы давало относительно мало света. Это было проблемой до XVIII в., когда швейцарский ученый по имени Ами Арганд изобрел новый тип масляной лампы, где фитиль в форме рукава был защищен прозрачным стеклом. Лампа была устроена так, что воздух мог проходить сквозь середину кольцевого пламени, и поступление кислорода к огню – а значит, эффективность и яркость устройства – радикально улучшились. Такая лампа по светимости была эквивалентна шести или семи свечам. Это изобретение повлекло множество других новшеств, и со временем стало ясно, что оливковое масло, как и другие растительные масла, – не идеальное топливо. Для более яркого света нужны более высокие температуры, для них – более быстрое капиллярное поднятие, а его скорость определяется поверхностным натяжением и вязкостью жидкости. Попытки найти дешевые масла с низкой вязкостью вдохновили ученых на множество экспериментов и, как ни печально, вызвали гибель множества китов.

Добыча кашалота. Джон Уильям Хилл (1835). © Yale University Art Gallery
Китовая ворвань получается при кипячении полос китового жира. Масло, которое вываривается из него, отличается чистым медовым цветом. Оно не слишком хорошо подходит для готовки или собственно в пищу из-за сильного рыбного запаха, но имеет низкую вязкость, а точка возгорания у него равна 230°C. Поэтому ворвань очень хороша для масляных ламп.
Использование ворвани в лампах Арганда резко подскочило в конце XVIII в., особенно в Европе и Северной Америке. В 1770–1775 гг. китобои Массачусетса, пытаясь удовлетворить растущий спрос, производили по 45 000 бочек китовой ворвани ежегодно. Охота, подпитываемая нуждой во внутреннем освещении, стала настоящей индустрией, и некоторые виды китов оказались почти полностью истреблены ради удовлетворения этой потребности. По разным оценкам, к началу XIX в. ради добычи жира было убито более четверти миллиона китов.
Долго так продолжаться не могло, но потребность во внутреннем освещении по-прежнему росла. Население увеличивалось и богатело, всё большее значение придавалось образованию, культура чтения и развлечений после наступления темноты входила в массы, так что спрос на масла только рос. Одновременно усиливалось и давление на изобретателей и ученых, которые должны были предложить способ удовлетворения этой потребности. Среди них был и Джеймс Янг, шотландский химик, который в 1848 г. нашел способ получения из угля жидкости, прекрасно подходившей для лампы. Он назвал ее парафиновым маслом. Канадский изобретатель Авраам Геснер проделал то же и назвал свою жидкость керосином. Эти открытия могли и не привести к серьезным результатам, однако сделаны они были перед самым началом Гражданской войны в Америке. Китобойные суда стали мишенью для военных кораблей, а налоги на другие виды ламповых масел дали керосиновой промышленности удачную возможность для старта. Однако реальный прорыв произошел только тогда, когда изобретатели начали возиться не с углем, а с сырой нефтью, которую можно было обнаружить возле угольных шахт. Ее приходилось выкачивать из земли, это черная, пахучая, липкая субстанция. Но, прежде чем ее применить, пришлось освоить дистилляцию – старый фокус, впервые использованный еще ар-Рази и оказавшийся чрезвычайно выгодным. Теперь джинна действительно выпустили из бутылки.
Тем временем на борту моего самолета по-прежнему не было сказано ни слова о керосине. Инструктаж по безопасности дошел до пункта об аварийных выходах, и один из проводников встал в проходе и развел руки с растопыренными пальцами, указывая нам их расположение. Мне сказали, что позади меня два таких выхода, и впереди два, и еще два над крыльями. Мне хотелось добавить: «А еще 50 000 литров керосина в баке у нас под ногами и по столько же в каждом из крыльев лайнера». Должно быть, я пробормотал что-то себе под нос, поскольку привлек внимание соседки, которую, как я позже выяснил, звали Сьюзен. Впервые после посадки в самолет она подняла голову от книги. На мгновение она встретилась со мной глазами поверх очков в красной оправе, затем вернулась к чтению. Ее взгляд хотя и длился меньше секунды, но успел сказать мне очень многое. Он говорил: «Расслабьтесь. Самолет – самое безопасное средство перемещения на большие расстояния. Знаете ли вы, что каждый день больше миллиона людей летает в стратосфере и шансы на то, что произойдет что-то плохое, мизерные? Нет, даже меньше. Сядьте поудобнее. Расслабьтесь. Почитайте книгу». Я понимаю, что здесь очень много информации для передачи взглядом, но поверьте мне, ее короткий взгляд сказал мне всё это.

Нефтеперегонный завод; высокие колонны – дистилляционные сосуды. © Kyle Pearce
К счастью или нет, но я не мог думать ни о чем, кроме керосина – и замечательного фокуса, который изобретатели середины XIX в. использовали для переработки сырой нефти: метода перегонки. Ар-Рази для этого применял аппарат, известный как аламбик, – примерно то же, что мы сегодня называем дистилляционными, или ректификационными, сосудами. Это те самые колонны, которые торчат вверх из всех нефтеперегонных заводов.
Сырая нефть – смесь углеводородных молекул различной формы: и длинных, как спагетти, и более компактных, и замкнутых в кольца. Хребет каждой такой молекулы состоит из атомов углерода, связанных последовательно в цепочку. С каждым атомом углерода связаны также два атома водорода, при этом есть множество вариантов молекул, различающихся формой и размерами: атомов углерода в молекуле может быть от пяти до нескольких сотен штук. Молекул с числом атомов углерода меньше пяти очень мало, потому что они склонны существовать в форме газов: это метан, этан и бутан. Чем длиннее молекула, тем выше температура кипения вещества – и вероятность того, что при комнатной температуре оно будет жидкостью. Это верно для углеводородных молекул с числом атомов углерода примерно до сорока. Если молекула еще больше, то она практически не может плавать, и вещество становится смолой.
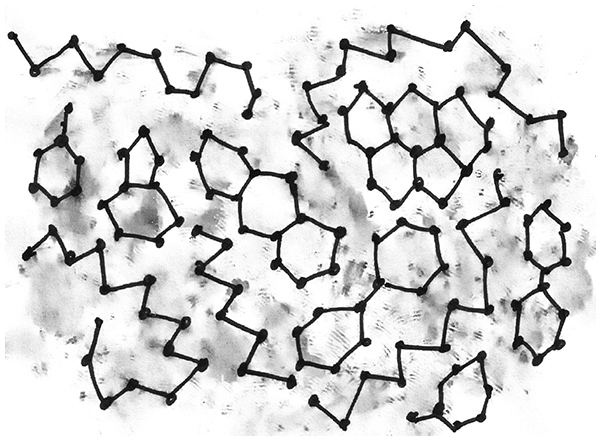
Смесь углеводородных молекул в составе сырой нефти (показаны только атомы углерода)
При перегонке сырой нефти первыми выделяются самые маленькие молекулы. Молекулы углеводорода с числом атомов углерода от пяти до восьми образуют светлую прозрачную и чрезвычайно горючую жидкость. Точка возгорания для нее равна –45°C, то есть даже при минусовых температурах она легко вспыхивает. Так легко, что заливать ее в масляную лампу опасно. Поэтому в самом начале развития нефтяной промышленности эту жидкость считали отходом производства и выбрасывали. Позже, когда мы лучше разобрались в ее достоинствах, мы ее оценили – особенно за то, что, если ее смешать с воздухом и поджечь, она дает достаточно горячего газа, чтобы двигать поршень машины. Позже ее назвали бензином и начали использовать как топливо для двигателей внутреннего сгорания.
Более крупные молекулы с числом атомов углерода 9–21 образуют прозрачную светлую жидкость с более высокой температурой кипения. Она испаряется медленно, ее не так просто поджечь. Но поскольку каждая молекула в ней довольно велика, если реакция с кислородом всё же возникает, энергии в ней выделяется много, причем в виде горячего газа. Однако жидкость не загорится, если ее не впрыснуть в воздух; кроме того, ее можно сжать до высокой плотности, прежде чем она самопроизвольно вспыхнет. Именно этот принцип открыл в 1897 г. Рудольф Дизель, имя которого в итоге получила жидкость, ставшая основой его грандиозного изобретения – самого успешного двигателя XX столетия.
Но во времена младенчества нефтяной отрасли, в середине XIX в., дизельный двигатель еще не был изобретен, зато имелась настоятельная потребность в горючей жидкости для масляных ламп. И производители создали жидкость, в которой молекулы содержали по шесть – шестнадцать атомов углерода. Она где-то посередине между бензином и дизельным топливом. Имеет достоинства дизельного топлива – не испаряется настолько быстро, чтобы образовывать взрывоопасные смеси, – но при этом с очень низкой вязкостью, близкой к вязкости воды. Капиллярное поднятие у нее проходит великолепно, что позволяет пламени гореть очень ярко. Жидкость оказалась дешевой и эффективной и не требовала для производства оливковых рощ или китов. Это был керосин – идеальное ламповое масло.
Но безопасен ли он? На какое-то время мое сознание отвлеклось от происходящего – я пытался расслабиться, следуя невысказанному совету Сьюзен, – но теперь внимание вновь переключилось на бортпроводников. Они, продолжая инструктаж по безопасности, перешли к рассказу о спасательных жилетах. На каждом из них уже был такой жилет, и проводники делали вид, что свистят в свисток. Я представил себе, каково это – выжить при аварийной посадке на воду и оказаться в море, возможно ночью, пытаясь свистеть. Я также подумал о том, что происходит с керосином в баках самолета в случае такой посадки. Может ли он взорваться?
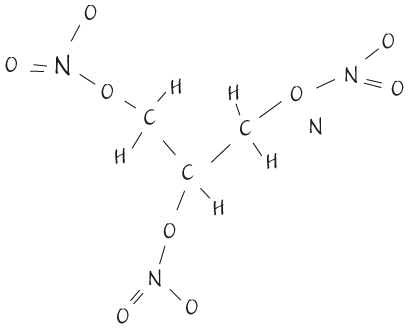
Структурная формула молекулы нитроглицерина
Мне известна по крайней мере одна жидкость, которая точно могла бы взорваться в таких обстоятельствах: нитроглицерин. Как и керосин, он бесцветный, прозрачный и маслянистый. Первым его синтезировал итальянский химик Асканио Собреро в 1847 г. Он не убил создателя – чудо, если учесть, что это невероятно опасное и нестабильное химическое вещество, вполне способное неожиданно взорваться. Асканио был так напуган возможными перспективами использования этого химиката, что год не сообщал о своем открытии, да и потом пытался удержать других химиков от изготовления опасного вещества. Но его ученик Альфред Нобель сумел разглядеть потенциал изобретения; Нобель решил, что оно может заменить порох. Со временем ему удалось привести нитроглицерин в относительно безопасную форму. Альфред превратил жидкость в твердое вещество, которое уже не склонно случайно взрываться (хотя и убило его брата Эмиля), и создал динамит. Изобретение Нобеля перевернуло горную промышленность и обогатило создателя. До динамита горнодобывающие компании вынуждены были полагаться на ручной труд: туннели, выработки и шахты копали вручную. Свое состояние – по крайней мере, его часть – Нобель использовал для учреждения самой известной в мире международной премии.
Как и бензин, дизельное топливо и керосин, нитроглицерин состоит из углерода и водорода. Но в нем есть и добавки: атомы кислорода и азота. Их присутствие и положение в молекуле делают нитроглицерин нестабильным. Если молекула оказывается под давлением в результате контакта с чем-то или вибрации, она легко распадается. Тогда атомы азота собираются вместе и образуют газ, а атомы кислорода реагируют с углеродом и образуют диоксид углерода (CO2), или углекислый газ. Они также реагируют с водородом, образуя пар, а из того, что остается, получается дополнительный газ – кислород. Распадаясь, молекула создает в нитроглицерине ударную волну, которая вызывает распад соседних молекул, что создает еще больше газа и поддерживает волну. В итоге все молекулы вещества распадаются в результате цепной реакции, которая идет со скоростью, в тридцать раз превышающей скорость звука, и почти мгновенно превращает жидкость в горячий газ. Объем газа тысячекратно превосходит объем жидкости, поэтому он стремительно расширяется, вызывая сильнейший тепловой взрыв. Очень многие разрушения Второй мировой войны объясняются широким использованием взрывчатых веществ на основе нитроглицерина.
Ограничение в 100 мл на количество жидкости, разрешенное к провозу в авиалайнерах, придумано для того, чтобы не дать злоумышленнику пронести на борт достаточно жидкой взрывчатки, такой как нитроглицерин, чтобы разрушить самолет. Вещество все равно взорвется, конечно, но энергии будет недостаточно, чтобы самолет упал. Однако мысль о том, что в одном литре керосина содержится в десять раз больше энергии, чем в литре нитроглицерина, а в топливных баках самолета этого керосина десятки тысяч литров, действует отрезвляюще.
Но керосин – не взрывчатка, он не умеет спонтанно взрываться. В отличие от нитроглицерина, у него в структуре молекулы нет атомов ни кислорода, ни азота. Это стабильная молекула, которая не распадается так легко. Керосин можно бить, давить, в нем можно даже купаться – он не взорвется. Он мощнее нитроглицерина, но если вы хотите обуздать его, то вам, в отличие от случая с нитроглицерином, придется потрудиться: нужно заставить его реагировать с кислородом. При реакции керосина и кислорода образуется CO2 и водяной пар, но, поскольку скорость реакции ограничена доступом к кислороду, воспламенение можно контролировать.
Мощь керосина и наша способность управляемо сжигать его придают этой жидкости такое важное технологическое значение. Сейчас земная цивилизация сжигает примерно миллиард литров керосина в день, в основном в реактивных двигателях и космических ракетах, но во многих странах он и сегодня используется для освещения и обогрева. В Индии, например, больше 300 млн человек освещают свои дома керосиновыми лампами.