Наталья Трунилина Белки. Часть 2: обмен и синтез
ОБМЕН БЕЛКОВ.
Часть первая.
I. Определение и биологическая роль белков.
БЕЛКИ – высокомолекулярные биополимеры, состоящие из аминокислот, соединённых в определённой последовательности, и имеющие структурную организацию.
Структурную (составная часть всех организмов).
Каталитическую (ферменты – биологические катализаторы).
Регуляторную (гормоны, некоторые из них – белки).
Транспортную (альбумины и другие).
Дыхательную (гемоглобин).
Сократительную (белки мышц).
Защитную (иммуноглобулины).
Рецепторную (белки – рецепторы).
Опорно-двигательную функцию (коллаген) и другие функции.
Норма белка 80-120 г/сут.
II. Полноценные и неполноценные белки.


Критериями полноценности белков являются:
Количественное и качественное соотношение аминокислот, близкое по составу к белкам человека.
Наличие эссенциальных аминокислот.
Усвояемость белков.

III. Заболевания связанные с белковой недостаточностью.
Недостаточность белкового питания ведет к заболеванию – «квашиоркор», что обозначает «золотой» (или красный) мальчик, в Центральной Африке, где дети питаются бананами, просо, кукурузой. Характерна резкая задержка роста, анемия, отёки, жировая инфильтрация печени, атрофия поджелудочной железы, поражение почек. У лиц негройдной расы волосы приобретают красно-коричневый оттенок.
Смертность 50-90%.

К жировой инфильтрации печени и циррозу приводит недостаточность МЕТИОНИНА. Дефицит ГИСТИДИНА сопровождается анемией и другими заболеваниями.
IV. Азотистый баланс.
Азотистый баланс – это отношение количества азота поступившего с пищей к количеству азота теряемого организмом с мочой, фекалиями, потом в составе азотсодержащих соединений (мо-чевины, мочевой кислоты, креатинина и др.).

V. Переваривание белков в желудке.
В полости рта белки не перевареваются. Переваривание белков происходит в желудке и кишечнике под действием эндо и экзопротеиназ.
5.1 Желудочный сок.

5.2 HCl. Биологическая роль.
Денатурация белков.
Бактерицидное действие.
Активирует пепсиноген.
Создаёт оптимум рН для пепсина.
Усиливает всасывание железа.
Стимулирует выделение гормоноидов: секретина, холецитокинина, панкрео-зимина и др.
5.3 Образование HCl.


5.4 Регуляция HCl.

5.5 Определение HCl в клинике.


При онкологии в желудочном соке образуется лактат, в связи с тем глюкоза идёт по анаэробному пути (гликолиз). В желудке фермент:

5.6 Пепсин – образование активной формы, механизм действия.
Пепсин образуется из пепсиногена в результате ограниченного протеолиза, то есть это гидролиз белка с отщеплением части белковой молекулы и образованием активной формы.
Пепсин – эндопротеиназа, рН 1.5-2.0 расщепляет связи образованные NН2 группами ароматических аминокислот: ФЕН, ТИР и ТРИ, а также связи между АЛА-АЛА, АЛА-СЕР, АЛА-ГЛИ, ЛЕЙ-ГЛУ.
Образуются высокомолекулярные пептиды.
VI. Переваривание белков в кишечнике.
6.1 Трипсин, образование активной формы.
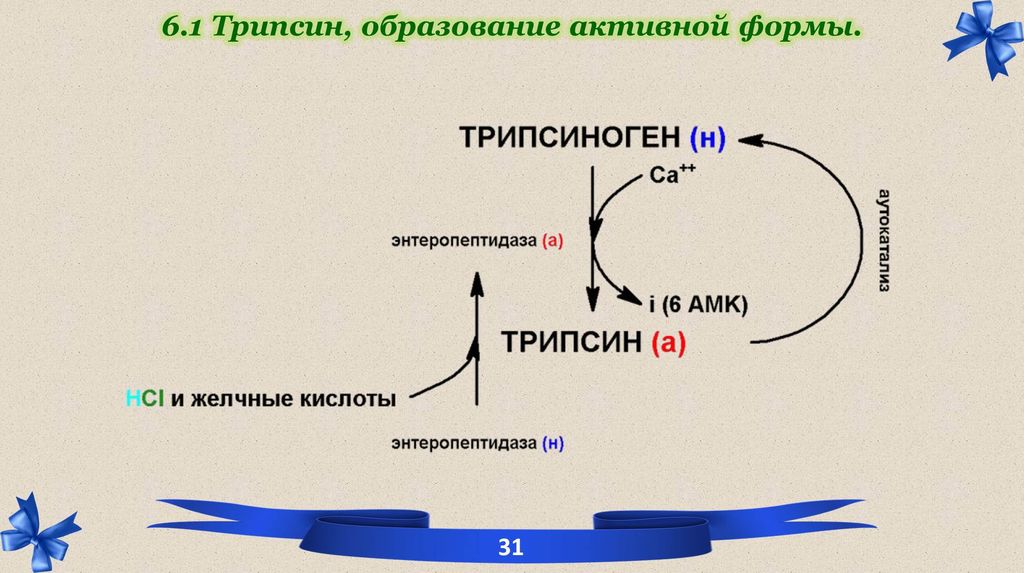
Трипсин – эндопротеиназа, (рН-7,8) действует на пептидные связи, образованные СОО- группами АРГИНИНА и ЛИЗИНА. Образуются низкомолекулярные пептиды.
6.2 Химотрипсин, образование активной формы, механизм действия.

Химотрипсин – эндопротеиназа, (рН 7.8) гидролизует пептидные связи, образованные СОО- группами ароматических аминокислот. Образуются низкомолекулярные пептиды.
6.3 Экзопротеиназы. Образование активных форм и механизм действия.



VII. Специфические эндопептидазы.

Эластаза и коллагеназа расщипляют связи в эластине и коллагене образовывая аминокислоты с короткими радикалами: ГЛИ, АЛА, СЕР. Однако лишь незначительное количество этих белков гидролизуется в кишечнике. Переваривание белков заканчивается образованием аминокислот.

VIII. Превращение аминокислот под действием микрофлоры кишечника.

8.1 Декарбоксилирование АМК.
Декарбоксилирование аминокислот приводит к образованию таких продуктов:
Кадаверин (из ЛИЗИНА).
Путресцин (из ОРНИТИНА).

Кадаверин и путресцин – активные диамины, выводятся с мочой. А также:
Фенилэтиламин (из фенилаланина).
Тирамин (из тирозина).
Гистамин (из гистидина).
Триптамин (из триптофана).
Это мощные вазоактивные вещества. Такие как гистамин образуются в тканях организма. Из цистина, цистеина и метионина образуется H2S (сероводород) и CH3SH (метилмеркаптан).
8.2 Укорочение боковой цепи. Образование индола и фенола.


8.3 Обезвреживание индола и фенола в печени.


Коньюгированные соединения из печени → кровь → почки → мочу.
8.4 Гиппуровая кислота. Значение в клинике. Проба Квика-Пытеля.
Гиппуровая кислота – продукт обезвреживания бензойной кислоты. Образуется в печени при участии ГЛИЦИНА.



Часть вторая.
I. Всасывание аминокислот.
Некоторые аминокислоты проходят через мембрану Na+ – независимой облегчённой диффузией. При вторичном активном транспорте перенос аминокислот идёт с участием Na+, K+ – АТФ-азы за счёт ассиметричного переноса Na+, K+ – АТФ-азой ионов: три иона Na+ наружу в обмен на поглощение двух ионов K+. В плазматических мембранах клеток слизистой оболочки тощей кишки обнаружены специфические белки – переносчики (не менее пяти). Каждый переносит определённые группы аминокислот.

Некоторые аминокислоты всасываются при участии γ-глутамильного цикла.

Ключевая роль принадлежит γ-глутамил-трансферазе, кофактор – глутатион (γ-глутамил-цистеинил-глицин). Аминокислота сое-диняясь с γ-глутаминным остатком образует дипептид который и переносится внутрь клетки, далее аминокислота уходит в кровь, а глутатион ресинтезируется при участии (Е3, Е4, Е5, Е6) и цикл вновь повторяется. Всасавшиеся аминокислоты через кровь поступают в органы и ткани. В плазме крови их концентрация (в пересчёте на N) составляет
3,5 – 5,5 ммоль/л.
II. Распад тканевых белков.
2.1 Пополнение запаса аминокислот в клетках.
Запас аминокислот пополняется в клетках тканей за счёт:
Транспорта аминокислот.
Образование заменимых аминокислот.
Внутриклеточного гидролиза собственных белков, который осуществляется тканевыми протеиназами локализованными в лизосомах (85-90%).
2.2 Протеасома.
Протеасомы (цитоплазматические белковые комплексы) имеют бочковидную форму.
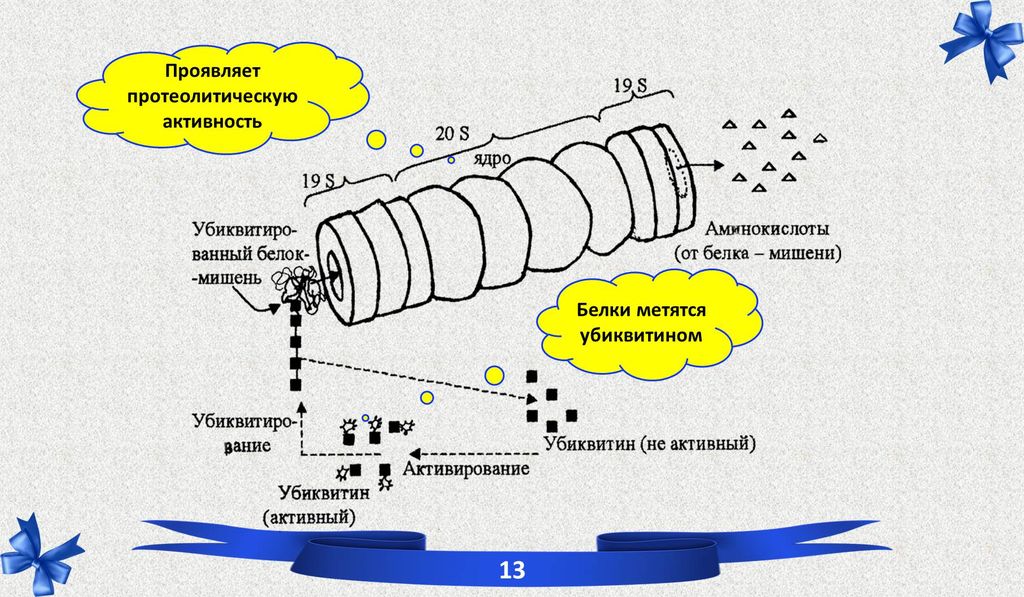
2.3 Лизосомальные протеиназы.
Лизосомальные протеиназы – катепсины отличаются оптимум рН и субстратной специфичностью.

В результате их действия образуются аминокислоты и дипептиды, которые расщепляются до аминокислот.
III. Судьба аминокислот в тканях.

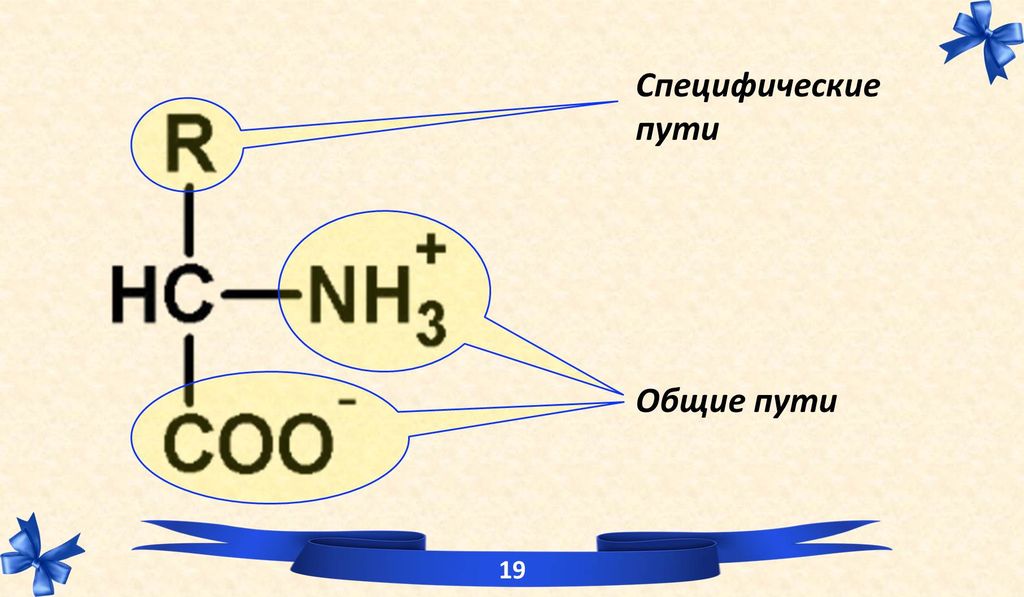
IV. Общие пути обмена аминокислот.

V. Дезаминирование.
5.1 Прямое окислительное дезаминирование.
В печени и почках окислительное дезаминирование могло бы происходить так как есть ФАД-зависимые L-оксидазы, но их рН=10.0, и отсюда они практически не активны. Исключения составляет глицин и глутамат.
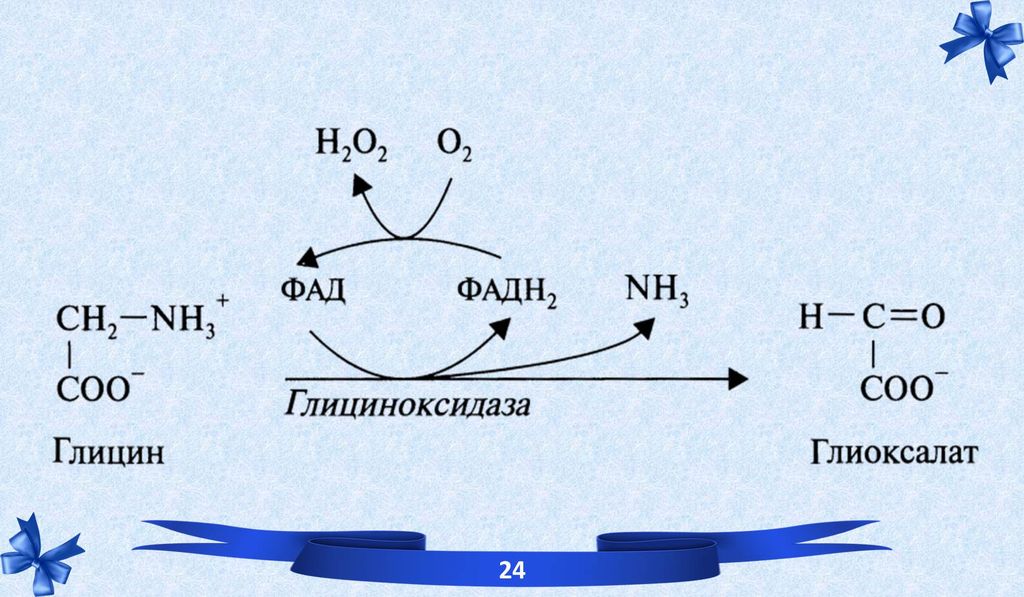
Окислительное дезаминирование глутамата идёт в матриксе митохондрий всех тканей и органов, кроме мышц и головного мозга.

5.2 Прямое неокислительное дезаминирование.
Рассмотрим на примере внутримолекулярного дезаминирования гистидина, которое происходит в печени и коже.